Faktor stisljivosti, kako izračunati, primere in vaje
- 1437
- 109
- Miguel Gutmann DVM
On Faktor stisljivosti z, o Kompresijski faktor za pline je brezdimenzionalna vrednost (brez enot), ki je uvedena kot popravek v enačbi stanja idealnih plinov. Na ta način matematični model bolj spominja na opaženo vedenje plina.
V idealnem plinu je enačba stanja, ki se nanaša na spremenljivke P (tlak), V (prostornina) in T (temperatura): Str.V idealno = n.R.T z n = število molov in r = konstanta idealnih plinov. Če dodamo korekcijo faktorja stiskanja z, se ta enačba spremeni v:
Str.V = z.n.R.T
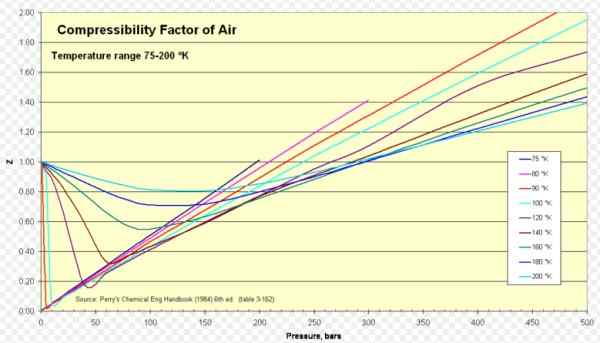
 Slika 1. Faktor stisljivosti zraka. Vir: Wikimedia Commons. https: // nalaganje.Wikimedia.org/wikipedia/commons/8/84/compressional_factor_of_air_75-200_k.PNG.
Slika 1. Faktor stisljivosti zraka. Vir: Wikimedia Commons. https: // nalaganje.Wikimedia.org/wikipedia/commons/8/84/compressional_factor_of_air_75-200_k.PNG. [TOC]
Kako izračunati faktor stisljivosti?
Ob upoštevanju, da je molarni volumen Vkul = V/n, Imate pravi molarni volumen:
Str . VResnično = Z. R. T → Z = PV Resnično/Rt
Ker je faktor stisljivosti z odvisen od pogojev plina, se izraža kot funkcija tlaka in temperature:
Z = z (p, t)
Če primerjamo prve dve enačbi, je ugotovljeno, da če je število molov n enako 1, je molarna prostornina resničnega plina povezana z novico idealnega plina do:
VResnično / Videalno = Z → V Resnično = Z videalno
Ko tlak presega 3 atmosfere, se večina plinov neha obnašati kot idealni plini in realna volumen se bistveno razlikuje od ideala.
To je v svojih poskusih uresničil nizozemski fizik Johannes van der Waals (1837-1923), zaradi česar je ustvaril model, ki se je bolje prilagodil praktičnim rezultatom kot enačba idealnih plinov: državna enačba van der Waals.
Vam lahko služi: natrijev oksalat (NA2C2O4): struktura, lastnosti, uporabe, tveganjaPrimeri
Glede na enačbo Str.VResnično= Z.n.Rt, Za idealen plin, z = 1. Vendar pa v resničnih plinih s povečanjem pritiska tudi vrednost z. To je smiselno, ker imajo pri večjih tlačnih molekulah več možnosti za trčenje, zato se sile odbojnosti povečajo in s tem glasnost.
Po drugi strani se molekule premikajo z večjo svobodo in sile odbojnosti se zmanjšajo. Zato se pričakuje manjši volumen. Kar se tiče temperature, ko se poveča, se z zmanjša.
Kot je opazil van der Waals, je v bližini tako imenovane kritične točke plina zelo preusmerjeno iz idealnega plina.
Kritična točka (tc, Strc) katere koli snovi so vrednosti tlaka in temperature, ki določajo njihovo vedenje pred spreminjanjem faze:
-Tc To je temperatura, nad katero zadevni plin ni utekočinjen.
-Strc To je minimalni tlak, potreben za utekočinjenost plina pri temperaturi tc
Vsak plin ima svojo kritično točko, ki določa temperaturo in znižan tlak tr In pr kot sledi:
Strr = P / Pc
Vr = V /vc
Tr = T /Tc
Opazimo, da je plin omejen z enakim Vr in Tr Izvedite enak pritisk Strr. Zaradi tega, če je z grafično, odvisno od Strr na isto Tr, Vsaka točka v tej krivulji je enaka za kateri koli plin. To se imenuje Načelo ustreznih držav.
Faktor stisljivosti v idealnih plinih, zraku, vodiku in vodi
Spodaj je krivulja stisljivosti za različne pline pri različnih znižanih temperaturah. Nato nekaj primerov Z za nekaj plinov in postopek za iskanje Z z uporabo krivulje.
Vam lahko služi: vodik: zgodovina, struktura, lastnosti in uporabe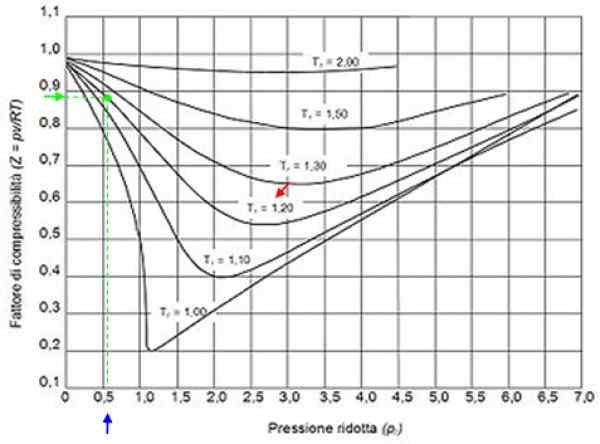 Slika 2. Grafična faktorska grafika za pline v skladu z zmanjšanjem tlaka. Vir: Wikimedia Commons.
Slika 2. Grafična faktorska grafika za pline v skladu z zmanjšanjem tlaka. Vir: Wikimedia Commons. Idealni plini
Idealni plini imajo z = 1, kot je razloženo na začetku.
Zrak
Za zrak je z približno 1 v širokem razponu temperatur in pritiskov (glej sliko 1), kjer idealni model plina daje zelo dobre rezultate.
Vodik
Z> 1 za vse pritiske.
Voda
Za iskanje z vodo so potrebne vrednosti kritične točke. Kritična točka vode je: Pc = 22.09 MPA in Tc= 374.14 ° C (647.3 K). Ponovno je treba upoštevati, da je faktor stisljivosti z odvisen od temperature in tlaka.
Recimo, da želite najti z iz vode pri 500 ° C in 12 MPa. Potem je prva izračunati znižano temperaturo, za katero je treba Celzijeve stopnje prenesti na Kelvin: 50 ° C = 773 K:
Tr = 773/647.3 = 1.2
Strr = 12/22.09 = 0.54
S temi vrednostmi najdemo v grafu slike krivulja, ki ustreza tr = 1.2, označeno z rdečo puščico. Nato v vodoravni osi pogledamo vrednost pr Bližje 0.54, označeno v modri barvi. Zdaj narišemo navpično, dokler ne prestrežemo t krivuljer = 1.2 in končno je od te točke projiciran do navpične osi, kjer beremo približno vrednost z = 0.89.
Rešene vaje
Vaja 1
Obstaja vzorec plina pri temperaturi 350 K in tlak 12 atmosfer, pri čemer je molarni volumen 12 % višji od predvidenega zakona o idealnih plinih. Izračunati:
a) z kompresijski faktor.
b) molarna prostornina plina.
Vam lahko služi: nepopravljiva reakcija: značilnosti in primeric) Glede na zgornje rezultate navedite, katere so prevladujoče sile v tem vzorcu plina.
Podatki: r = 0,082 l.bankomat/mol.K
Rešitev
Vedeti, da je v Resnično je 12 % višji od Videalno :
VResnično = 1.12Videalno
Z = v Resnično / Videalno = 1.12
Rešitev b
Str . VResnično = Z. R. T → VResnično = (1.12 x 0.082 x 350/12) l /mol = 2.14 l/mol.
Rešitev c
Sile odbojnosti so tiste, ki prevladujejo, saj se je volumen vzorca povečal.
Vaja 2
V prostornini 4 je 10 molov etana.86 L A 27 ° C. Poiščite pritisk, ki ga ima Ethan iz:
a) Idealen plin
b) enačba van der waals
c) Poiščite faktor stiskanja iz prejšnjih rezultatov.
Podatki za etana
Koeficienti Van Der Waals:
A = 5.489 dm6. Bankomat . mol-2 in b = 0.06380 dm3. mol-1.
Kritični tlak: 49 atm. Kritična temperatura: 305 K
Rešitev
Temperatura se prenese na Kelvin: 27 ° C = 27 +273 K = 300 K, tudi ne pozabite, da je 1 liter = 1 l = 1 dm3.
Nato se podatki, navedeni v idealni enačbi plina, nadomestijo:
Str.V = n.R.T → P = (10 x 0,082 x 300/4.86 l) atm = 50.6 atm
Rešitev b
Državna enačba Van der Waals je:
Kjer sta a in b koeficienta, ki jih daje izjava. Pri čiščenju P:
Rešitev c
Izračunamo znižani tlak in temperaturo:
Strr = 35.2/49 = 0.72
Tr = 300 /305 = 0.98 ≈ 1
S temi vrednostmi se zahteva vrednost z v grafu slike 2 in ugotovi, da je z približno 0.7.
Reference
- Atkins, str. 1999. Fizikalna kemija. Omega izdaje.
- Cengel in. 2012. Termodinamika. 7ma Izdaja. McGraw Hill.
- Engel, t. 2007. Uvod v fizikokemijo: termodinamika. Pearson.
- Levine, i. 2014. Načela fizike-kemije. 6. Izdaja. McGraw Hill.
- Wikipedija. Faktor stisljivosti. Pridobljeno iz: v.Wikipedija.org.

