Zgodovina, opis in zaključki eksperimenta Rutherford
- 1581
- 26
- Ricky Dach
On Eksperiment Rutherford, Izvedeno med letoma 1908 in 1913, sestavljen iz bombardiranja tankega zlatega lista 0.0004 mm debel, z alfa delci in analizirajte disperzijski vzorec, ki ga ti delci pustijo na fluorescentnem zaslonu.
Pravzaprav je Rutherford izvedel številne eksperimente in podrobneje izpopolnjeval vedno več. Po natančni analizi rezultatov sta bila razkrita dva zelo pomembna sklepa:
-Pozitivna obremenitev atoma je koncentrirana v regiji, imenovanem jedro.
-To atomsko jedro je neverjetno majhno v primerjavi z velikostjo atoma.
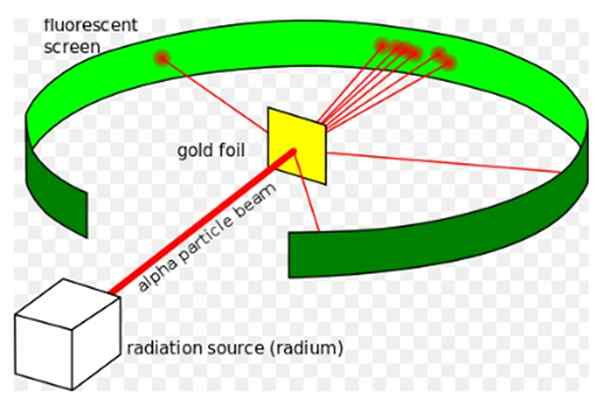
 Slika 1. Rutherfordov eksperiment. Vir: Wikimedia Commons. Kurzon [cc by-sa 3.0 (https: // creativeCommons.Org/licence/by-sa/3.0)]
Slika 1. Rutherfordov eksperiment. Vir: Wikimedia Commons. Kurzon [cc by-sa 3.0 (https: // creativeCommons.Org/licence/by-sa/3.0)] Ernest Rutherford (1871-1937) je bil fizik, rojen na Novi Zelandiji, katerega zanimivo področje je bila radioaktivnost in narava materije. Radioaktivnost je bila nedavni pojav, ko je Rutherford začel svoje poskuse, leta 1896 ga je odkril Henri Becquerel.
Leta 1907 se je Rutherford preselil na Univerzo v Manchestru v Angliji, da bi preučil strukturo atoma in uporabil te alfa delce kot sonde za pregled notranjosti tako majhne strukture. Fizikala Hans Geiger in Ernest Marsden sta ga spremljala pri nalogi.
Vzpostavili so upanje, kako so alfa delček, ki je dvojni ioniziran atom helija.
Vendar je večina alfa delcev prečkala zlato listo, ki je trpela le majhen odstopanje.
To dejstvo je bilo v celoti v skladu s Thomsonovim atomskim modelom na presenečenje raziskovalcev, majhen odstotek alfa delcev pa je doživel precej izjemen odklon.

In še manjši odstotek vrnjenih delcev, ki so popolnoma odskočili nazaj. Zakaj so bili ti nepričakovani rezultati?
[TOC]
Opis in zaključki poskusa
Pravzaprav so alfa delci, ki jih Rutherford uporablja kot sonda, jedra helija in takrat je bilo znano le, da imajo ti delci pozitiven naboj. Danes je znano, da so alfa delci sestavljeni iz dveh protonov in dveh nevtronov.
Delle Alfa in Beta je Rutherford opredelil kot dve različni vrsti sevanja iz urana. Delci alfa, veliko bolj masivni od elektrona, imajo pozitiven električni naboj, medtem ko so beta delci lahko elektroni ali pozitroni.
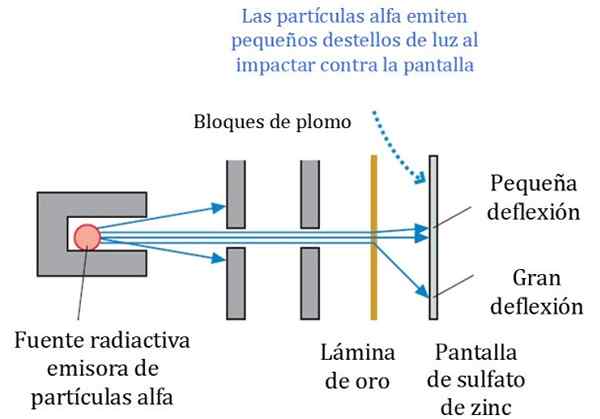 Slika 2. Podrobna shema eksperimenta Rutherford, Geiger in Marsden. Vir: r. Vitez. Fizika za znanstvenike in inženiring: strateški pristop. Pearson.
Slika 2. Podrobna shema eksperimenta Rutherford, Geiger in Marsden. Vir: r. Vitez. Fizika za znanstvenike in inženiring: strateški pristop. Pearson. Slika 2 prikazuje poenostavljeno shemo poskusa. Žarek alfa delcev prihaja iz radioaktivnega vira. Geiger in Marsden sta kot oddajalec uporabljala Radon Gas.
Svivni bloki so bili uporabljeni za usmerjanje sevanja na zlati list in preprečijo, da bi se neposredno ustavili na fluorescenčnem zaslonu. Svinec je material, ki absorbira sevanje.
Vam lahko služi: centriole: funkcije in značilnostiNato je bil usmerjen snop tako vplival na tanko zlato pločevino in večina delcev sledi poti do fluorescentnega zaslona cinkovega sulfata, kjer so pustili majhen svetlobni odtis. Geiger je bil zadolžen, da jih je štel ena za drugim, čeprav so nato zasnovali napravo, ki je to storila.
Dejstvo, da so nekateri delci doživeli majhen odklon, ni presenetilo Rutherforda, Geigerja in Marsdena. Konec koncev, v atomu obstajajo pozitivni in negativni naboji, ki imajo moč na alfa delcih, a ker je atom nevtralen, kar so že vedeli, bi morala biti odstopanja majhna.
Presenečenje poskusa je, da je bilo nekaj pozitivnih delcev skoraj neposredno odskočenih.
Zaključki
Približno 1 od 8000 alfa delcev je doživelo odklon pod koti, večjimi od 90 °. Malo, a dovolj, da dvomim o nekaterih stvareh.
Atomski model v Bogi je bil Thomsonov Pudin, nekdanji profesor iz Rutherforda v Laboratoriju Cavendish, vendar se je spraševal, ali ideja o atomu brez jedra in z elektroni, vgrajenimi kot roizini, je bilo pravilno.
Ker se izkaže, da so ti veliki odkloni alfa delcev in dejstvo, da se jih nekaj lahko vrne, lahko razložimo le, če ima atom majhno, težko in pozitivno jedro. Rutherford je domneval, da so za kakršno koli odstopanje odgovorne samo sile električne privlačnosti in odbojnosti, kot je navedeno v zakonu Coulomb.
Ko se nekateri alfa delci neposredno približujejo jedru in ker se električna sila spreminja glede na obratni kvadrat razdalje, začutijo odbojnost, ki jim povzroči disperzijo velikega kota ali odstopanja nazaj.
Da bi zagotovili, da sta Geiger in Marsden doživela bombne liste različnih kovin, ne le zlata, čeprav je bila ta kovina najprimernejša za njihovo pokvarljivost, da bi ustvarila zelo fine liste.
Pri pridobivanju podobnih rezultatov je Rutherford prepričal, da je treba pozitivno obremenitev v atomu namestiti v jedru in se ne razprši v celotnem volumnu, kot je Thomson postavil v svojem modelu.
Po drugi strani pa se je, tako kot velika večina alfa delcev, zgodilo brez odstopanja, jedro bi moralo biti zelo, zelo majhno v primerjavi z atomsko velikostjo. Vendar je moralo to jedro koncentrirati večino mase atoma.
Vplivi v atomskem modelu
Rezultati so bili zelo presenečeni nad Rutherfordom, ki je na konferenci v Cambridgeu razglasil: "... tako je, ko streljate na kroglo s 15 -palčnimi topovi na list svilenega papirja in izstrelki odskočijo neposredno in vas zadenejo".
Vam lahko služi: 10 funkcij teoretičnega okvira preiskaveKer teh rezultatov ni bilo mogoče razložiti s Thomsonovim atomskim modelom, je Rutherford predlagal, da atom sestavlja jedro, zelo majhno, zelo masivno in pozitivno obremenjeno. Elektroni so ostali opisani orbite okoli njih, katere sončni miniaturni sistem.
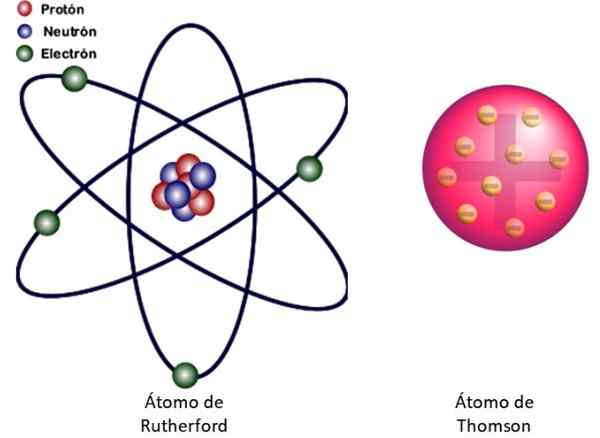 Slika 3. Na levi strani atomskega modela Rutherforda in na desni model Thomsonovega tipa Buddin. Vir: Wikimedia Commons. Leva slika: jcymc90 [cc by-sa 4.0 (https: // creativeCommons.Org/licence/by-sa/4.0)]
Slika 3. Na levi strani atomskega modela Rutherforda in na desni model Thomsonovega tipa Buddin. Vir: Wikimedia Commons. Leva slika: jcymc90 [cc by-sa 4.0 (https: // creativeCommons.Org/licence/by-sa/4.0)] To je jedrski model atoma, prikazan na sliki 3 na levo. Ker so elektroni zelo, zelo majhni, se izkaže, da je atom skoraj vse .. . prazno! Zato večina alfa delcev prečka list, ne da bi samo odstopala.
In analogija z miniaturnim osončjem je zelo uspešna. Atomsko jedro igra vlogo sonca, ki vsebuje skoraj celotno maso in pozitivno obremenitev. Elektroni krožijo okoli njih kot planeti in nosijo negativno obremenitev. Set je električno nevtralen.
O porazdelitvi elektronov v atomu, Rutherfordov eksperiment ni pokazal ničesar. Lahko bi mislili, da bodo alfa delci imeli nekaj interakcije z njimi, vendar je masa elektronov premajhna in ne bi mogla bistveno preusmeriti delcev.
Slabosti v modelu Rutherforda
Težava tega atomskega modela je bila ravno vedenje elektronov.
Če ti ne bi bili statični, ampak orbiranje atomskega jedra v krožnih ali eliptičnih orbitah, usmerjenih z električno privlačnostjo, bi na koncu hiteli v jedro.
To je zato, ker pospešeni elektroni izgubljajo energijo, in če se to zgodi, bi bil to propad atoma in snovi.
Na srečo se to ne zgodi. Obstaja nekakšna dinamična stabilnost, ki se izogne propadu. Naslednji atomski model po Rutherfordu je bil Bohr, ki je dal nekaj odgovorov, zakaj se atomski propad ne pojavi.
Proton in nevtron
Rutherford je še naprej izvajal disperzijske poskuse. Med letoma 1917 in 1918 sta se s pomočnikom Williama Kay odločila za bombardiranje.
Ponovno je bilo presenečeno, ko je zaznal jedra vodika. To je reakcijska enačba, prva umetna jedrska transmutacija ni nikoli dosegla:
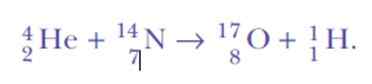 No, če so alfa delci jedra helija, od kod lahko vodikova jedra?
No, če so alfa delci jedra helija, od kod lahko vodikova jedra?
Odgovor je bil: iz istega dušika. Rutherford je dodelil atomsko številko 1 vodik, ker je najpreprostejši element vseh: pozitivno jedro in negativni elektron.
Rutherford je našel temeljni delček, ki ga je poklical proton, ime, ki izhaja iz grške besede do najprej. Na ta način je proton bistvena sestavina vsakega atomskega jedra.
Vam lahko služi: glasnostKasneje, do leta 1920, je Rutherford predlagal, da bi moral obstajati nevtralni delček in z maso, ki je zelo podobna masi protona. Klical je ta delček nevtron in je del skoraj vseh znanih atomov. Fizik James Chadwick ga je končno identificiral leta 1932.
Kako je model lestvice vodikovega atoma?
Atom vodika je, kot smo rekli, najpreprostejši od vseh. Vendar modela za ta atom ni bilo enostavno razložiti.
Naslednja odkritja so povzročila kvantno fiziko in celotno teorijo, ki opisuje pojave atomske ravni. V tem procesu se je razvijal tudi atomski model. Toda poglejmo vprašanje velikosti:
Atom vodika ima jedro, sestavljeno iz protona (pozitiven) in ima en sam elektron (negativen).
Polmer atoma vodika je bil ocenjen na 2.1 x 10-10 m, medtem ko je proton 0.85 x 10 -petnajst m ali 0.85 femtometri. Ime te majhne enote je posledica Enrico Fermi in se veliko uporablja pri delu na tej lestvici.
No, količnik med polmerom atoma in jedro je od vrstnega reda 105 M, torej atom je 100.000 -krat večji od jedra!.
Vendar moramo upoštevati, da v sodobnem modelu, ki temelji na kvantni mehaniki, elektron vključuje jedro v nekakšen oblak, imenovan orbitalno (Orbital ni orbita) in elektron v atomskem obsegu ni natančen.
Če je atom vodika široko razširjen - do velikosti nogometnega igrišča, bi bilo jedro, sestavljeno iz pozitivnega protona raztresen po polju in obkroža pozitivno jedro.
Atomski model danes
Ta "planetarni" atomski model je zelo zakoreninjen in je podoba, ki jo ima večina ljudi iz atoma, saj ga je zelo enostavno vizualizirati. Vendar, ni Model, ki je bil danes sprejet na znanstvenem področju.
Sodobni atomski modeli temeljijo na kvantni mehaniki. Poudarja, da elektron v atomu ni malo točka z negativno obremenitvijo, ki sledi natančnim orbitom, kot so tisti, ki si jih predstavlja Rutherford.
Nasprotno, elektron je raztreseno Na območjih okoli pozitivnega jedra, imenovanega atomske orbitale. Od njega lahko vemo verjetnost da se srečujejo v eni ali drugačni državi.
Kljub temu je model Rutherforda pomenil velik napredek pri poznavanju notranje strukture atoma. In napadli so pot, da bi ga več raziskovalcev še naprej izpopolnjevali.
Reference
- Andriessen, m. 2001. Tečaj HSC. Fizika 2. Jacaranda HSC Science.
- Arfken, g. 1984. Univerzitetna fizika. Akademski tisk.
- Vitez, r. 2017. Fizika za znanstvenike in inženiring: strateški pristop. Pearson.
- Fizika OpenLab. Eksperiment Rutherford-Geiger-Marsden. Okrevano od: PhysicsOpenLab.org.
- Rex, a. 2011. Osnove fizike. Pearson.
- Tyson, t. 2013. Eksperiment razprševanja Rutherforda. Okrevano od: 122.Fizika.Ucdavis.Edu.
- Xaktly. Rutherfordovi poskusi. Okreval od: xaktly.com.
- Wikipedija. Eksperiment Rutherford. Okrevano od: je.Wikipedija.org.
- « Značilnosti prehrane samodejne stopnje, stopnje, vrste, primeri
- Anna Freud Biografija, teorije, obrambni mehanizmi, dela »

