Etano
- 1056
- 169
- Percy Feeney
 Struktura Estana
Struktura Estana Kaj je etan?
On Etano To je preprost ogljikovodik formule C2H6 Z brezbarvno in toaletno plinsko naravo, ki ima zelo dragoceno in raznoliko uporabo v sintezi etilena. Poleg tega je eden od kopenskih plinov, ki so ga odkrili tudi na drugih planetih in zvezdnih telesih okoli sončnega sistema. Leta 1834 ga je odkril znanstvenik Michael Faraday.
Med velikim številom organskih spojin, ki jih tvorijo atomi ogljika in vodikov (znani kot ogljikovodiki), obstajajo tiste, ki so v plinastim stanju pri temperaturah in okoljskih pritiskih, ki se močno uporabljajo v številnih panogah.
Običajno izvirajo iz plinaste mešanice, imenovane "zemeljski plin", produkt visoke vrednosti za človeštvo in med drugim sestavljajo vrste metana, etana, propana in butana; kvalifikacija glede na količino ogljikovih atomov v svoji verigi.
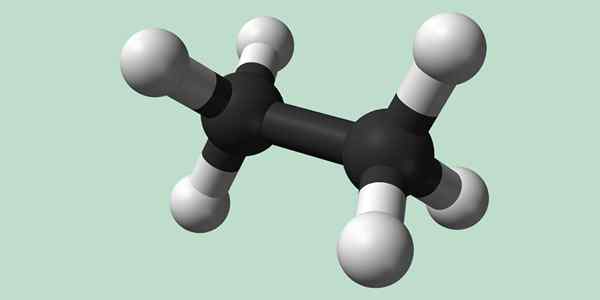
Kemična struktura etana
Estano je molekula formule C2H6, Običajno ga obravnavamo kot združitev dveh metilnih skupin (-CH3) Oblikovati ogljikovodik preproste vezi iz ogljikovega ogljika. Je tudi najpreprostejša organska spojina po metanu, ki predstavlja sebe:
H3C-ch3
Ogljikovi atomi v tej molekuli imajo hibridizacijo vrste SP3, Torej imajo molekularne vezi proste vrtenje.
Obstaja tudi notranji pojav Etano, ki temelji na vrtenju njegove molekularne strukture in na minimalni energiji, potrebni za proizvodnjo rotacije 360 -stopinj, ki so jo znanstveniki poimenovali "Etano Barrera".
Zaradi tega Ethan.
 Kemična struktura etana. Vir: Wikimedia Commons
Kemična struktura etana. Vir: Wikimedia Commons Sinteza etana
Estano je mogoče enostavno sintetizirati iz elektrolize Kolbe, organske reakcije, v kateri se pojavita dva koraka: elektrokemična dekarboksilacija (odstranitev karboksilne skupine in osvoboditev ogljikovega dioksida) dveh karboksilnih kislin in kombinacije izdelkov vmesnih izdelkov, ki tvorijo kovalentno vez.
Podobno ima elektroliza ocetne kisline nastajanje etana in ogljikovega dioksida in ta reakcija se uporablja za sintezo prve.
Oksidacija ocetnega anhidrida z delovanjem peroksidov, koncepta, podoben elektrolizi Kolbe, povzroči tudi nastanek etana.
Vam lahko služi: prispevki od kemije do človeštvaNa enak način ga je mogoče učinkovito ločiti od zemeljskega plina in metana s postopkom utekočinjanja z uporabo kriogenih sistemov za zajem tega plina in ločevanje od mešanic z drugimi plini.
Postopek razširitve turbo je najljubši za to vlogo: plinsko mešanico izdeluje turbina, ki ustvarja širitev, dokler njegova temperatura ne pade pod -100 ° C.
Že v tem trenutku je mogoče diferencirati sestavne dele mešanice, tako da bo tekoči etan od plinastega metana in druge vrste, ki sodelujejo pri uporabi destilacije.
Estano lastnosti
Estano je v naravi predstavljen kot stranišče in brezbarven plin za standardne tlake in temperature (1 atm in 25 ° C). Ima vrelišče -88,5 ° C in fuzijsko točko -182,8 ° C. Poleg tega ne vpliva izpostavljenost močnim kislinam ali bazam.
Topnost etana
Etano molekule so simetrična konfiguracija in imajo šibke sile privlačnosti, ki jih ohranjajo skupaj, imenovane disperzijske sile.
Ko se Etan poskuša raztopiti v vodi, so sile privlačnosti, ki nastanejo med plinom in tekočino.
Zaradi tega je topnost etana bistveno nizka, rahlo se poveča, ko se sistemski tlak dvigne.
Kristalizacija etana
Estano je mogoče utrditi, s čimer je nestabilni etanski kristali s kubično kristalno strukturo.
Z znižanjem temperature, ki presega -183,2 ° C, ta struktura postane monoklinična, kar povečuje stabilnost njegove molekule.
Izgorevanje etana
Ta ogljikovodik, tudi če se ne uporablja kot gorivo, se lahko uporablja v procesih zgorevanja za ustvarjanje ogljikovega dioksida, vode in toplote, ki je predstavljen na naslednji način:
2 c2H6 + 72 → 4CO2 + 6H2O + 3120 kJ
Obstaja tudi možnost zažganja te molekule brez presežka kisika, ki je znan kot "nepopolno zgorevanje", kar ima za posledico nastanek amorfnega ogljika in ogljikovega monoksida v neželeni reakciji glede na količino uporabljenega kisika:
Vam lahko služi: sterole: struktura, funkcije in primeri2 c2H6 + 3. mesto2 → 4C + 6H2Ali + toplota
2 c2H6 + 42 → 2C + 2CO + 6H2Ali + toplota
2 c2H6 + 52 → 4CO + 6H2Ali + toplota
Na tem območju se zgorevanje zgodi z nizom reakcij prostih radikalov, ki so oštevilčene v stotine različnih reakcij. Na primer, v nepopolnih reakcijah zgorevanja se lahko tvorimo spojine, kot so formaldehid, acetaldehid, metan, metanol in etanol.
To bo odvisno od pogojev, v katerih se pojavijo reakcija in reakcije prostih radikalov. Etilen se lahko tvori tudi pri visokih temperaturah (600-900 ° C), kar je zelo zaželen izdelek industrije.
Estano v atmosferi in v nebesnih telesih
Estano je prisoten v ozračju planeta Zemlje v sledovih in sumimo, da je človeku to koncentracijo uspelo podvojiti, saj je začel izvajati industrijske dejavnosti.
Znanstveniki menijo, da je velik del trenutne prisotnosti ETA v atmosferi posledica zgorevanja fosilnih goriv, čeprav se je svetovna emisija etana skoraj na polovici zmanjšala, odkar so se izboljšale tehnologije proizvodnje plina Lutita (vir zemeljskega plina).
Ta vrsta se naravno pojavlja tudi zaradi učinka sončnih žarkov na atmosferski metan, ki rekombinira in tvori etansko molekulo.
Na površini Titana, ene od Saturnovih lun, je etan v tekočem stanju. To je predstavljeno v večji količini na reki Vid Flumina, ki teče več kot 400 kilometrov do enega od svojih morij. Ta spojina je bila dokazana tudi na kometih in na površini Plutona.
Uporaba etana
Proizvodnja etilena
Uporaba etana temelji predvsem na proizvodnji etilena, na organskem produktu večje uporabe v svetovni proizvodnji, s postopkom, znanim kot pare.
Ta postopek je sestavljen iz prehoda razredčenega etana.
Reakcija se pojavi pri izjemno visoki temperaturi (med 850 in 900 ° C), vendar mora biti čas bivanja (čas, ki ga etan prehaja znotraj pečice) kratek, tako da je reakcija učinkovita. Pri višjih temperaturah nastane več etilena.
Vam lahko služi: Neon: Zgodovina, lastnosti, struktura, tveganja, uporabeOsnovna kemična tvorba
Etano je bil preučen tudi kot glavna sestavina pri oblikovanju osnovnih kemikalij. Oksidativna kloriranje je eden od procesov, ki se sprožijo za pridobitev vinil klorida (komponenta PVC), ki nadomešča druge manj ekonomične in bolj zapletene.
Hladilno sredstvo
Nazadnje se etan uporablja kot hladilno sredstvo v skupnih kriogenih sistemih, ki prikazuje tudi zmogljivosti zamrzovanja majhnih vzorcev v laboratoriju za analizo.
To je zelo dober nadomestek za vodo, ki potrebuje več za hlajenje občutljivih vzorcev in lahko ustvari tudi tvorbo škodljivih ledenih kristalov.
Tveganja za etana
-Estano ima sposobnost vnetja, predvsem ko se pridruži zraku. Odstotek od 3,0 do 12,5% volumna etana v zraku, lahko tvorimo eksplozivno zmes.
-Lahko omeji kisik v zraku, v katerem ga najdemo, in zaradi tega predstavlja dejavnik tveganja za zadušitev za ljudi in živali, ki so prisotne in izpostavljene.
-Etan v zamrznjeni tekoči obliki lahko resno kuri kožo, če pride v neposreden stik z njo, in deluje tudi kot kriogeni medij za kateri koli predmet, ki se dotakne, v trenutkih, ki ga zamrzne.
-Hlapi tekočega etana so težji kot zrak in se osredotočijo na tla, kar lahko predstavlja tveganje za vžig, ki lahko ustvari reakcijo izgorevanja verige.
-Etano zaužitje lahko povzroči slabost, bruhanje in notranje krvavitve. Vdihavanje poleg zadušitve povzroča tudi glavobole, zmedo in spreminjanje humorja. Smrt zaradi srčnega zastoja je mogoča na visokih razstavah.
-Predstavlja toplogredni plin, ki skupaj z metanom in ogljikovim dioksidom prispeva k globalnemu ogrevanju in podnebnih spremembah, ki jih povzroča onesnaževanje ljudi. Na srečo je manj obilen in trajen kot metan, in absorbira manj sevanja kot to.
Reference
- Britannica, e. (s.F.). Etan. Pridobljeno od Britannice.com
- NES, g. V. (s.F.). Enokristalne strukture in porazdelitev gostote elektronov etana, etilena in acetilena. Ponovna preproga.Nl
- Spletna mesta, g. (s.F.). Etan: viri in ponori. Pridobljeno s spletnih mest.Google.com
- SoftSchools (s.F.). Etanska formula. Okrevano iz mehkih šol.com
- Wikipedija (s.F.). Etan. Pridobljeno iz in.Wikipedija.org

