Etanamidna struktura, lastnosti, uporabe, učinki
- 1728
- 74
- Dexter Koch
The etanamid To je kemikalija, ki spada v skupino dušikovih organskih spojin. Po podatkih Mednarodne zveze čiste in uporabne kemije se imenuje tudi acetamid (IUPAC). Komercialno se imenuje ocetna kislina.
Imenuje se Amida, ker je dušik povezan s karbonilno skupino. Primarno je, ker ohrani dva vodikova atoma, združena z dušikom -nh2. V naravi so ga našli kot mineral le v suhem času; V deževnem ali zelo vlažnem času se raztopi v vodi.
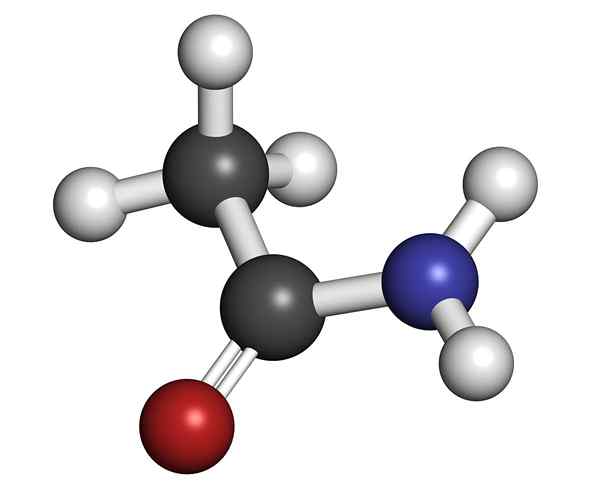
 Molekularna struktura acetamida
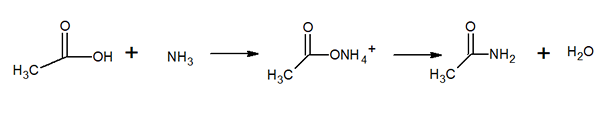
Molekularna struktura acetamida Je trdna trdna snov (prozorna). Njegova barva sega od brezbarvne do sive, tvori majhne stalaktite in včasih zrnate agregate. Pojavi se lahko z reakcijo med ocetno kislino in amoniakom, ki tvori vmesno sol: amonijev acetat. Potem je to dehidrirano za proizvodnjo amide in oblikovanje vode:
[TOC]
Kemična struktura
Notranja kemična struktura acetamidnega kristala je trigonalna, toda ko se združi, da tvori aglomerate, pridobi oktaedrsko obliko.
Strukturna formula spojine je sestavljena iz acetilne skupine in amino skupine:
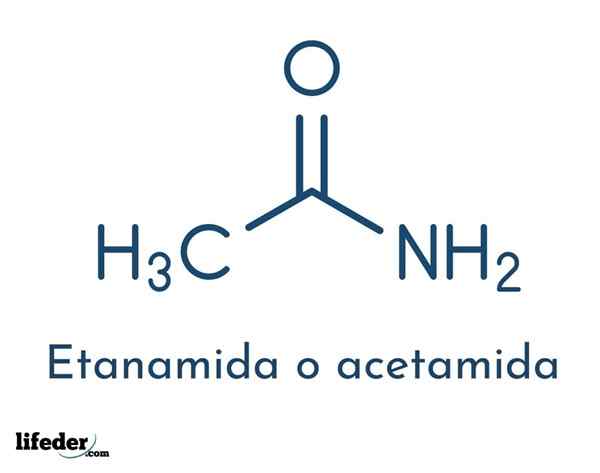
Te skupine omogočajo različne reakcije, ki jih je mogoče izvesti spojino. Molekularna formula acetamida je c2H5Ne.
Fizikalne lastnosti etanamida
Videz | So kristali, ki segajo od brezbarvnih do sivih. |
Vonj | Stranišče. Ko ima nečistoče, ima vonj po amonijak-urejo. |
Ideja | Najdemo ga v naravi, poleg rudnikov v koreninah sladkorne pese, v vinu, ki je oksidiral v presežku, in v dimu tobaka. |
Molarna masa | 59.07 g/ml |
Gostota vode | 1.159 g/cm³ |
Tališče | Med razponom 79 ° C-81 ° C |
Vrelišče | 221 ° C |
Topnost vode, etanol, piridin, kloroform, glicerol in benzen | Zelo topno |
Parni tlak | 1.3x10-5 atm. |
Kemične lastnosti
Kemične lastnosti snovi se nanašajo na njihovo reaktivnost, kadar so v prisotnosti drugih, ki lahko povzročijo preoblikovanje v njegovo strukturo. Acetamid predstavlja naslednje reakcije:
Vam lahko služi: Faraday ConstantKislina in osnovna hidroliza
Pri kislinski hidrolizi reagira z anorgansko kislino pri visoki temperaturi, da tvori karboksilno kislino in amonijevo sol.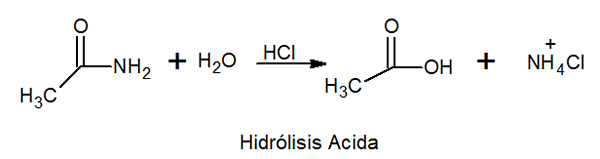
Pri osnovni hidrolizi se pojavijo kovinska in amonijanska sol.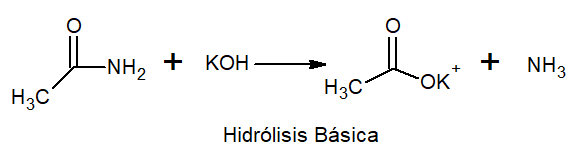
Zmanjšanje
Zmanjšanje pomeni povečanje vodika, zato ta reakcija povzroči primarni amin, imenovan etanamin ali etilamin. Reduktor je litijev hidrid in aluminij lialh4. 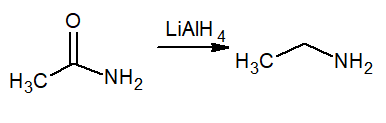
Dehidracija
Ta izraz kaže na izgubo vode iz molekule. Uporabljajo se kot dehidrirajoči reagenti tionilo klorid (SOCL2) ali fosforjevega pentoksida (P2Tudi5). Končni izdelek je nitril. 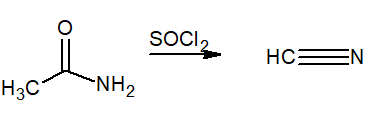
Na industrijskem področju je proizvodnja karboksilnih kislin zelo koristna zaradi pomena njegovih derivatov. Vendar ima pridobivanje etanske kisline iz acetamida zelo omejeno uporabo, ker visoke temperature, do katerih se postopek pojavlja, ponavadi razgradijo kislino.
V laboratoriju, čeprav lahko etanamid pridobimo iz ocetne kisline.
Lahko vam služi: ititrium: struktura, lastnosti, uporabe, pridobivanjeAcetamid uporablja
Acetamid se komercialno pojavlja od leta 1920, čeprav ni gotovo, da je do danes v komercialni uporabi. Prej so ga uporabljali za sintezo metilamina, tioacetamida, hipnotike, insekticidov in za medicinske namene.
Acetamid je spojina, ki se na industrijskem polju uporablja kot:
- Plastike, v usnju, filmih o tkaninah in premazih.
- Aditiv za papir, da se odpor in prilagodljivosti.
- Denaturacija alkoholov. V študij se doda alkoholu, da odstrani del čistosti, ki jo ima, in tako lahko služi drugim uporabi, na primer topilo.
- Lak, da zasije na površine in/ali zaščiti materialov pred agresiji okolja, zlasti korozije.
- Eksploziven.
- Ustanovitelj, odkar je dodan v snov, olajša zlitje tega.
- V krioskopiji.
- Kot vmesni del pri izdelavi zdravil, kot so ampicilin in antibiotiki, ki izhajajo iz cefalosporinov, kot so: glavobol, cefaleksin, toplota, enalaprilski malleat (zdravljenje s hipertenzijo) in sulfacetamid (protimikrobne oftalmične kapljice), med drugim.
- Topilo, saj nekatere snovi povečajo topnost v vodi, ko se v njem raztopi acetamid.
- Kot topilo, ki pritrdi barvila v tekstilni industriji.
- V izdelavi metilamina.
- Kot biocid v spojinah, ki jih je mogoče uporabiti kot razkužila, konzervansi, pesticidi itd.
Učinki na zdravje
V kemičnih panogah, kjer se acetamid uporablja kot topilo in plastizacijo, lahko delavci zaradi akutne (kratkoročne izpostavljenosti) predstavijo draženje kože s prisotnostjo teh spojin.
Ni podatkov o kroničnih učinkih (dolgoročno) ali razvoju rakotvornega rakotvornega razvoja pri ljudeh. Po podatkih ameriške agencije za varstvo okolja (EPA) acetamid ni razvrščen kot rakotvornik.
Lahko vam služi: brez elektrolitov: značilnosti in primeriMednarodna agencija za raziskave raka je acetamid razvrstila kot skupino 2B, možno človeško rakotvorno kancerogen.
Kalifornijska agencija za varstvo okolja je ugotovila oceno tveganja za vdihavanje 2 × 10-5 µg/m3 (mikrogram na kubični meter) in tveganje za oralni rak po zaužitju 7 × 10-2 mg/kg/d (miligramos za vsak kilogram v enem dnevu) dolgo časa.
Čeprav je splošna populacija lahko izpostavljena kajenju cigaret ali stiku s kožo z izdelki, ki vsebujejo acetamid, ne predstavlja veliko tveganja zaradi značilnosti topnosti in higroskopije, ki jo ima z vodo.
Z zemljo ga je enostavno premakniti skozi odtok, vendar naj bi ga mikroorganizmi poslabšali in se ne kopiči pri ribah.
Acetamid je rahlo dražilna koža in oči in ni na voljo podatkov, ki bi potrdili njegove strupene učinke na ljudi.
Pri laboratorijskih živalih smo opazili toksičnost pri izgubi telesne teže, ko je bil sčasoma zelo visok oralni odmerek. Vendar pri rojstvu mladih staršev, zdravljenih z acetamidom, niso opazili splavov ali škodljivih učinkov.
Reference
- Cosmos Online (od leta 1995), tehnične in komercialne informacije o acetamidu, ki so jih obnovili 23. marca 2018, Cosmos.com.mx
- Morrison, r., Boyd, r., (1998), Organska kemija (5. izdaja), Mehika, medameriški izobraževalni sklad, S.A de c.V
- Pine, s., Hammond, g., Cram, d., Hendrickson, j., (1982). Organska kemija, (druga izdaja), Mehika, McGraw-Hill de México, S.A de c.V
- Chemical Guide, (2013), Uporaba acetamida, obnovljena 24. marca 2018, Guiadeproductosquimicos.Blogspot.com.co
- Nacionalni center za informacije o biotehnologiji. PUBCHEM SOSTACIJSKA PODATKA; Cid = 178, acetamid. Obtoženi Pubchem.NCBI.NLM.ameriški nacionalni inštitut za zdravje.Gov

