Lewisova struktura, iz česa je sestavljena, kako je, primeri

- 1038
- 105
- Stuart Armstrong
The Lewisova struktura Je vse to predstavitev kovalentnih vezi znotraj molekule ali iona. V njem so te vezi in elektroni predstavljeni z dolgimi točkami ali skripti, čeprav točke točke ustrezajo ne skupnim elektronom in skriptom kovalentnim obveznikom.
Toda kaj je kovalentna povezava? Gre za skupno rabo nekaj elektronov (ali točk) med dvema atoma periodične tabele. S temi diagrami lahko za določeno spojino skicirate veliko okostnjakov. Katera od njih je prava odvisna od formalnih obremenitev in kemijske narave istih atomov.
 2-bromopropan spojina. Ben Million [Public Domain], iz Wikimedia Commons.
2-bromopropan spojina. Ben Million [Public Domain], iz Wikimedia Commons. Na vrhunski sliki je primer, kaj je Lewisova struktura. V tem primeru je predstavljena spojina 2-bromopropano. Črne točke, ki ustrezajo elektronom, je mogoče videti, tako tiste.
Če bi točke točk ":" nadomestili z dolgim skriptom "-", potem bi bil ogljikov okostje 2-bromopropano predstavljeno kot: C-C-C. Zakaj bi lahko namesto "molekularnega okvirja" narisal C-H-C? Odgovor je v elektronskih značilnostih vsakega atoma.
Torej, ker ima vodik na voljo samo en elektron in eno orbitalo, ki je na voljo, le kovalentna vez. Zato nikoli ne morete oblikovati dveh vezi (ne zamenjujte z vodikovimi mostovi). Po drugi strani elektronska konfiguracija ogljikovega atoma omogoča (in zahteva) tvorbo štirih kovalentnih vezi.
Iz tega razloga morata biti Lewisove strukture, kjer morata biti C in H dosledni in spoštujeta tisto, kar urejajo njihove elektronske konfiguracije. Če ima Carbon več kot štiri vezi ali vodik več kot eno, lahko skico izključimo in začnete novo v skladu z resničnostjo.
Tu se pojavljajo nekateri glavni razlogi ali hrbtni strani teh struktur, ki jih je predstavil Gilbert Newton Lewis v iskanju molekulskih reprezentacij, ki so zvesti eksperimentalnim podatkom: molekularna struktura in formalne obremenitve.
Vse obstoječe spojine lahko predstavljajo strukture Lewis, ki dajejo prvi pristop k temu, kako bi lahko bila molekula ali ioni.
[TOC]
Kaj je Lewisova struktura?
Gre za reprezentativno strukturo Valencije elektronov in kovalentnih vezi v molekuli ali ionu, ki služi za predstavo o njegovi molekularni strukturi.
Vendar ta struktura ne napoveduje nekaterih pomembnih podrobnosti, kot je molekularna geometrija glede na atom in okolico (če je kvadratna, ravna, bipiramidalna itd.).
Prav tako ne pove nič glede kemične hibridizacije njegovih atomov, toda kam so postavljene dvojice ali trojne vezi in če je v strukturi resonanca.
S temi informacijami se lahko prepirate o reaktivnosti spojine, njeni stabilnosti, kako in kakšnemu mehanizmu bo molekula sledila pri reakciji.
Zaradi tega Lewisove strukture nikoli ne prenehajo obravnavati in so zelo koristne, saj lahko kondenzirajo novo kemično učenje.
Kako je to?
Za risanje ali skiciranje strukture, formule ali Lewisovega diagrama je nujna kemijska formula spojine. Brez njega sploh ne morete vedeti, kaj so atomi, ki jih sestavljajo. Ko je z njim, se periodična tabela uporablja za iskanje, katere skupine pripadajo.
Vam lahko služi: viskoznost: primeri, vzroki, enote, vrsteNa primer, če imate sestavo c14Tudi2N3 Potem bi morali iskati skupine, kjer so ogljik, kisik in dušik. To je storilo, ne glede na spojino, število valenčnih elektronov ostaja enako, tako prej ali slej si zapomni.
Tako ogljik pripada skupini DDV, kisik v skupino Via in dušik v VA. Številka skupine je enaka količini elektronov (točk) Valencije. Vsi imajo skupno nagnjenost k dokončanju okteta plasti Valencije.
Kaj je pravilo okteta?
To pravi, da obstaja trend atomov za dokončanje svoje energijske ravni z osmimi elektroni, da bi dosegli stabilnost. To velja za vse nemetalne elemente ali tiste, ki jih najdemo v blokih S ali P periodične tabele.
Vendar pa vsi elementi ne upoštevajo pravila okteta. Posebni primeri so prehodne kovine, katerih strukture temeljijo na formalnih obremenitvah in njihovi številki skupine.
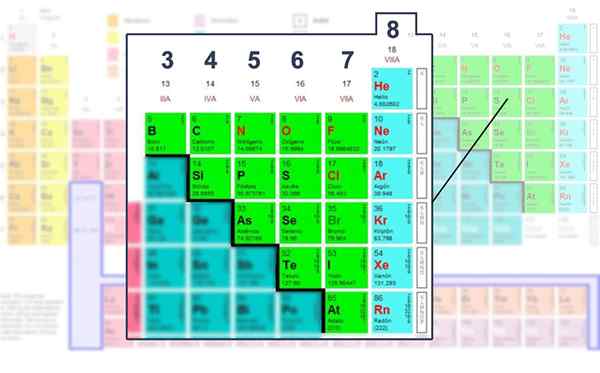 Število elektronov plasti Valencije nemetalnih elementov, tistih, v katerih je mogoče upravljati s strukturo Lewis.
Število elektronov plasti Valencije nemetalnih elementov, tistih, v katerih je mogoče upravljati s strukturo Lewis. Uporaba matematične formule
Če vemo, v katero skupino pripadajo elementi, in zato je število valenčnih elektronov, ki so na voljo za oblikovanje povezav, narejena naslednja formula, ki je uporabna za risanje Lewisovih struktur:
C = N - D
Kjer pomeni c skupni elektroni, torej tisti, ki sodelujejo v kovalentnih obveznicah. Ker je vsaka povezava sestavljena iz dveh elektronov, je c/2 enak številu povezav (ali skriptov), ki jih je treba narisati.
N so potrebni elektroni, Tisti, ki morajo imeti atom v svoji plasti Valencije, da je izolektronski do plemenitega plina, ki sledi v istem obdobju. Za vse elemente, ki niso H (ker potrebujeta dva elektrona za primerjavo z He), potrebujejo osem elektronov.
D so na voljo elektroni, ki jih določa skupina ali elektroni številke Valencije. Ker CL pripada skupini VIIA, mora biti obkrožen s sedmimi črnimi ali elektroni in ne pozabite, da je za tvorbo povezave potrebno par.
Ob atomih, njihovih točkah in številu povezav c/2 je mogoče improvizirati strukturo Lewisa. Toda poleg tega je treba imeti pojmovanje drugih "pravil".
Kam postaviti manj elektronegativne atome
Manj elektronegativni atomi v veliki večini struktur zasedajo centre. Zaradi tega, če imate spojino z atomi P, O in F, mora biti torej P v središču hipotetične strukture.
Pomembno je tudi poudariti, da so vodiki običajno povezani z zelo elektronegativnimi atomi. Če imate v spojini Zn, H in O, bo H šel zraven O in ne z Zn (Zn-O-H in brez H-Zn-O). Pri tem pravilu obstajajo izjeme, vendar se običajno pojavljajo pri nemetalnih atomih.
Simetrija in formalne obremenitve
Narava ima veliko prednost, da čim bolj simetrično povzroči molekularne strukture. To pomaga, da se izognemo dvigu motenj struktur, atomi pa so razporejeni tako, da ne ubogajo nobenega očitnega vzorca.
Lahko vam služi: kisline teorije: Arrhenius, Bronsted-Lowry, LewisNa primer za spojino c2Do3, Kjer je a izmišljeni atom, bi bila najverjetnejša struktura A-C-A-C-A. Upoštevajte simetrijo svojih strani, oba odseva drugega.
Tudi formalne obremenitve igrajo pomembno vlogo pri risanju Lewisovih struktur, zlasti za ione. Tako lahko povezave dodate ali odstranite tako, da formalna obremenitev atoma ustreza skupni prikazani obremenitvi. To merilo je zelo koristno za spojine prehodnih kovin.
Omejitve v pravilu okteta
 Predstavitev aluminija trifluorida, spojina, ki je nestabilna. Oba elementa sta sestavljena iz šestih elektronov, ki ustvarjajo tri kovalentne vezi, ko naj bodo osem za dosego stabilnosti. Vir: Gabriel Bolívar
Predstavitev aluminija trifluorida, spojina, ki je nestabilna. Oba elementa sta sestavljena iz šestih elektronov, ki ustvarjajo tri kovalentne vezi, ko naj bodo osem za dosego stabilnosti. Vir: Gabriel Bolívar Niso izpolnjena vsa pravila, kar ne pomeni nujno, da je struktura napačna. Tipični primeri tega opazimo v številnih spojinah, kjer so vključeni elementi skupine IIIA (B, AL, GA, IN, TL). Tu se posebej šteje za aluminijast trifluoruro (ALF3).
Nato uporabite zgoraj opisano formulo, imate:
D = 1 × 3 (aluminijast atom) + 7 × 3 (trije atomi fluora) = 24 elektronov
Tu sta 3 in 7 ustrezni skupini ali število valenčnih elektronov, ki so na voljo za aluminij in fluorid. Nato glede na potrebne elektrone n:
N = 8 × 1 (aluminijast atom) + 8 × 3 (trije atomi fluora) = 32 elektronov
In zato so skupni elektroni:
C = N - D
C = 32 - 24 = 8 elektronov
C/2 = 4 povezave
Ker je aluminij najmanj elektronegativni atom, ga je treba namestiti v sredino, fluor. Glede na to imate strukturo Lewis del Alf3 (Zgornja slika). Skupni elektroni so poudarjeni z zelenimi točkami, da jih ločimo od neobdelanih.
Čeprav izračuni napovedujejo, da obstajajo 4 povezave, ki jih je treba oblikovati, aluminij nima dovolj elektronov in tudi četrtega atoma fluora ni. Kot rezultat.
Primeri struktur Lewis
Jod
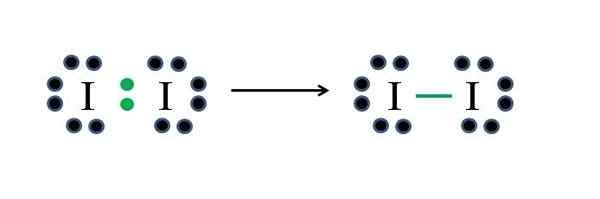 Jodo ne -metali imajo po sedem elektronov, tako da z deljenjem enega od teh elektronov ustvarijo kovalentno vez, ki jim daje stabilnost. Vir: Gabriel Bolívar
Jodo ne -metali imajo po sedem elektronov, tako da z deljenjem enega od teh elektronov ustvarijo kovalentno vez, ki jim daje stabilnost. Vir: Gabriel Bolívar Jod je halogen in zato spada v skupino VIIA. Nato ima sedem elektronov Valencije in ta preprosta diatomska molekula je mogoče predstavljati improviziranje ali uporabo formule:
D = 2 × 7 (dva atoma joda) = 14 elektronov
N = 2 × 8 = 16 elektronov
C = 16 - 14 = 2 elektrona
C/2 = 1 povezava
Ker 14 elektronov 2 sodeluje v kovalentni vezi (zelena točka in skript), 12 ostane kot deljenih; In ker sta dva atoma joda, je treba za enega od njih razdeliti 6 (njihovi valenčni elektroni). V tej molekuli je mogoča samo ta struktura, katere geometrija je linearna.
Amoniak
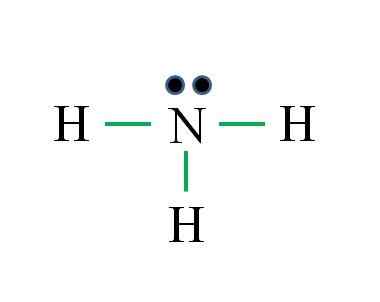 Dušik ima 5 elektronov, vodik pa le 1. Zadostuje za doseganje stabilnosti, ko so vzpostavljene tri kovalentne vezi, sestavljene iz elektrona N in drugega vira H: Gabriel Bolívar
Dušik ima 5 elektronov, vodik pa le 1. Zadostuje za doseganje stabilnosti, ko so vzpostavljene tri kovalentne vezi, sestavljene iz elektrona N in drugega vira H: Gabriel Bolívar Kaj je Lewisova struktura za molekulo amoniaka? Ker je dušik iz skupine VA, ima pet elektronov Valencije in nato:
Lahko vam služi: laboratorijski termometer: značilnosti, za kaj je, uporaba, primeriD = 1 × 5 (atom dušika) + 1 × 3 (trije vodikovi atomi) = 8 elektronov
N = 8 × 1 + 2 × 3 = 14 elektronov
C = 14 - 8 = 6 elektronov
C/2 = 3 povezave
Tokrat je formula prav s številom povezav (tri zelene povezave). Od 8 razpoložljivih elektronov 6 sodeluje v veznih veznih, na voljo je navor, ki se nahaja nad dušikovim atomom.
Ta struktura pravi vse, kar bi bilo treba poznati iz baze amoniaka. Z uporabo znanja o TEV in TRPEV sledi, da je geometrija tetraedrska izkrivljena s prostim dušikovim navorom in da je hibridizacija tega torej sp3.
C2H6Tudi
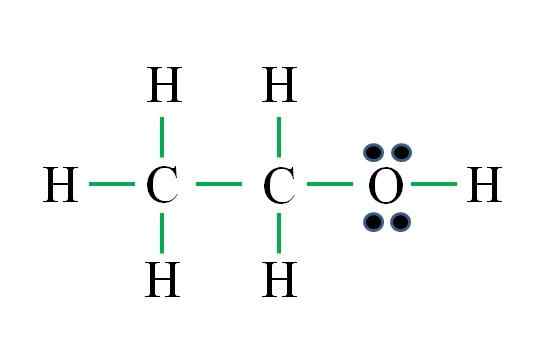 Vir: Gabriel Bolívar
Vir: Gabriel Bolívar Formula ustreza organski spojini. Preden uporabite formulo, je treba spomniti, da hidrogeni tvorijo eno samo vez, kisik dva, ogljik štiri in da mora biti struktura čim bolj simetrična. Potek kot prejšnji primeri so:
D = 6 × 1 (šest atomov vodika) + 6 × 1 (atom kisika) + 4 × 2 (dva atoma ogljika) = 20 elektronov
N = 6 × 2 (šest atomov vodika) + 8 × 1 (atom kisika) + 8 × 2 (dva atoma ogljika) = 36 elektronov
C = 36 - 20 = 16 elektronov
C/2 = 8 povezav
Število zelenih skriptov ustreza 8 izračunanim povezavam. Predlagana struktura Lewisa je etanol ch3Pogl2Oh. Vendar bi bilo tudi pravilno predlagati strukturo dimetil etra3Och3, kar je še bolj simetrično.
Kateri od obeh je "bolj" pravilen? Obe sta enako, saj so strukture nastale kot strukturni izomeri iste molekularne formule C2H6Tudi.
Permanganatni ion
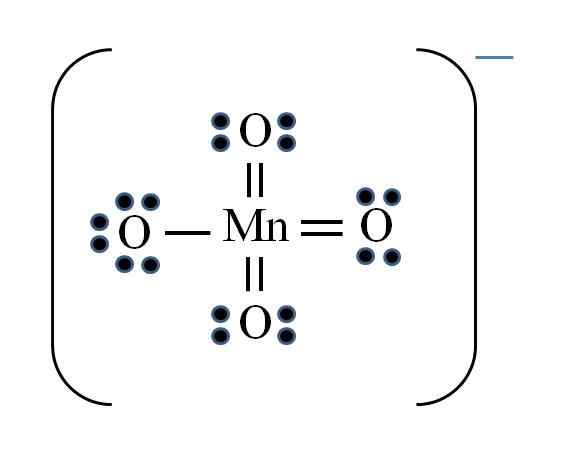 Vir: Gabriel Bolívar
Vir: Gabriel Bolívar Situacija je zapletena, ko želite narediti strukture Lewis za spojine prehodnih kovin. Mangan pripada skupini VIIB, tudi elektron negativne obremenitve je treba dodati med razpoložljive elektrone. Uporaba formule, ki jo imate:
D = 7 × 1 (manganov atom) + 6 × 4 (štirje atomi kisika) + 1 elektron na obremenitev = 32 elektronov
N = 8 × 1 + 8 × 4 = 40 elektronov
C = 40 - 32 = 8 skupnih elektronov
C/2 = 4 povezave
Vendar imajo lahko prehodne kovine več kot osem elektronov v Valenciji. Tudi za mno ion4- Ima negativno obremenitev, treba je zmanjšati formalne obremenitve atomov kisika. Kot? Prek dvojnih povezav.
Če vse povezave MNO4- Bili so preprosti, formalne obremenitve kisika bi bile enake -1. Ker so štiri, bi bila nastala obremenitev -4 za anion, kar očitno ni res. Ko se tvorijo dvojne vezi, je zagotovljeno, da ima en kisik negativno formalno obremenitev, ki se odraža v ionu.
V ionu permanganata je razvidno, da obstaja resonanca. To pomeni, da je edina preprosta povezava Mn-O demokalizirana med štirimi atomi O.
Dicromato ion
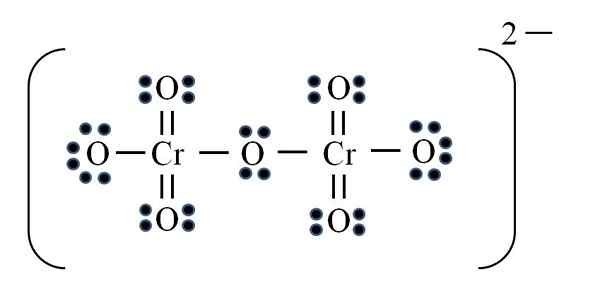 Vir: Gabriel Bolívar
Vir: Gabriel Bolívar Končno se pojavi podoben primer z dikromato ionom (CR2Tudi7). Chrome pripada skupini Vib, tako da ima šest elektronov Valencije. Znova uporaba formule:
D = 6 × 2 (dva atoma kroma) + 6 × 7 (sedem atomov kisika) + 2 elektrona z dvovalentno obremenitvijo = 56 elektronov
N = 8 × 2 + 8 × 7 = 72 elektronov
C = 72 - 56 = 16 skupnih elektronov
C/2 = 8 povezav
Vendar ni 8 povezav, ampak 12. Iz istih, ki jih najdemo, morata v ionu permanganata dva kisika ostati z negativnimi formalnimi obremenitvami, ki dodajo enako -2, obremenitev dikromato iona.
Tako se po potrebi doda veliko dvojnih povezav. Na ta način pridete do Lewisove strukture slike za CR2Tudi72-.
Reference
- Whitten, Davis, Peck & Stanley. Kemija. (8. izd.). Cengage Learning, P 251.
- Lewisove strukture. Vzet od: chemed.Kem.Purdue.Edu
- Steven a. Hardinger, Oddelek za kemijo in biokemijo, UCLA. (2017). Lewisova struktura. Vzet od: kem.UCLA.Edu
- Wayne Breslyn. (2012). Risanje Lewisovih struktur. Vzet iz: terpconnect.Umd.Edu
- Spletni skrbnik. (2012). Strukture Lewis ("Electron Dot"). Oddelek za kemijo, Univerza v Maineu, Orono. Vzeto iz: Kemija.Umeche.Maine.Edu
- Lancaster, Sean. (25. april 2017). Kako ugotoviti, koliko pik je na elementu Lewis Dot strukturi. Znanstvenik. Okrevano od: Znanstvenik.com

