Lastnosti mikroskopske lestvice, štetje delcev, primeri
- 3431
- 812
- Lee Farrell
The Mikroskopska lestvica To je tisti, ki se uporablja za merjenje velikosti in dolžin, ki jih ni mogoče videti s prostim očesom in ki so dolžine pod milimetrom. Od višje do najnižje so mikroskopske lestvice v metričnem sistemu:
- Milimeter (1 mm), ki je desetina centimetra ali tisoč metrov. V tem je lestvica, ki imamo eno največjih celic v telesu, ki je ovula, katere velikost je 1,5 mm.
 Slika 1. Rdeče krvne celice so mikroskopske celice. Vir: Pixabay
Slika 1. Rdeče krvne celice so mikroskopske celice. Vir: Pixabay - Deseta milimetra (0,1 mm). To je lestvica debeline ali premera človeških las.
- Mikrometer ali micra (1 μm = 0,001 mm). Na tej lestvici so rastlinske in živalske celice ter bakterije.
Rastlinske celice so od vrstnega reda 100 μm. Živalske celice so desetkrat manjše, od vrstnega reda 10 μm; Medtem ko so bakterije 10 -krat manj kot živalske celice in so v vrstnem redu 1 μm.
[TOC]
Nanometrična lestvica
Obstajajo še manjši ukrepi kot mikroskopska lestvica, vendar se običajno ne uporabljajo, razen v nekaterih posebnih okoliščinah. Nato bomo videli nekaj najpomembnejših nanometričnih ukrepov:
- Nanometer (1 ηm = 0,001 μm = 0,000001 mm) je milijon milimetra. Na tej lestvici je nekaj virusov in molekul. Virusi so vrstni red 10ηm in molekule reda 1ηm.
- Angstrom (1Å = 0,1ηm = 0,0001 μm = 10-7mm). Ta ukrep tvori atomsko lestvico ali velikost.
- Fantometer (1fm = 0,00001Å = 0,000001ηm = 10-12mm). To je lestvica atomskih jeder, ki so med 10 tisoč in 100 tisočkrat manjši od atoma. Vendar pa jedro kljub majhnosti koncentrira 99,99% atomske mase.
- Na atomskem jedru so manjše luske, saj so sestavljene iz delcev, kot so protoni in nevtroni. Vendar jih je še več: ti delci so sestavljeni iz bolj temeljnih delcev, kot so kvarki.
Instrumenti za mikroskopsko opazovanje
Ko so predmeti med milimetrom in mikrometrično lestvico (1 mm - 0,001 mm), jih lahko opazimo z optičnim mikroskopom.
Če pa so predmeti ali strukture med nanometri in angstromom, bodo potrebni elektronski ali nanoskopski mikroskopi.
V elektronski mikroskopiji se uporabljajo namesto svetlobne elektrone, ki imajo veliko nižjo valovno dolžino kot svetlobo. Pomanjkljivost elektronskega mikroskopa je, da ni mogoče.
Vam lahko služi: magnetni šok: enote, formule, izračun, primeriPo drugi strani se v nanoskopu uporablja laserska svetloba in ima prednost pred elektronsko mikroskopijo, da je mogoče videti in zabeležiti strukture in molekule znotraj žive celice.
Nanotehnologija je tehnologija, s katero se vezja, strukture, deli in celo motorji izdelujejo na lestvicah, ki segajo od nanometra do atomske lestvice.
Mikroskopske lastnosti
V fiziki se v prvem pristopu obnašanje snovi in sistemov preučuje z makroskopskega vidika. Iz te paradigme je zadeva neskončno deljiva kontinuum; In to stališče je veljavno in primerno za številne situacije vsakdanjega življenja.
Vendar imajo nekateri pojavi makroskopskega sveta samo razlago, če se upoštevajo mikroskopske lastnosti zadeve.
Na mikroskopskem vidiku se upošteva molekularna in atomska struktura zadeve. Za razliko od makroskopskega pristopa je na tej lestvici zrnata struktura z luknjami in presledki med molekulami, atomi in celo znotraj teh.
Druga značilnost mikroskopskega stališča v fiziki je, da je kos snovi, ne glede na to, kako majhen, sestavljen iz ogromnega števila delcev, ločenih drug od drugega in v neprekinjenem gibanju.
-Zadeva je neizmerna praznina
V majhni piti.
To pomeni, da je kos snovi na mikroskopski lestvici velika praznina s koncentracijami atomov in. V tem smislu ima mikroskopska lestvica podobnost z astronomsko lestvico.
Makroskopskih predmetov do odkritja atoma
Prve kemikalije, ki so bile alkimisti, so spoznale, da so materiali lahko dveh vrst: čiste ali spojine. To je doseglo idejo o kemičnih elementih.
Lahko vam služi: gradient tlaka: kaj je to in kako se izračunaPrvi kemični elementi so odkrili sedem kovin antike: srebro, zlato, železo, svinec, kositer, baker in živo srebro. Sčasoma so jih odkrili več, kolikor so bile našli snovi, ki se v drugih ne morejo razgraditi.
Nato smo elemente razvrstili glede na njihove lastnosti in značilnosti v kovinah in ne -kometah. Vsi, ki so imeli podobne kemijske lastnosti in afiniteto.
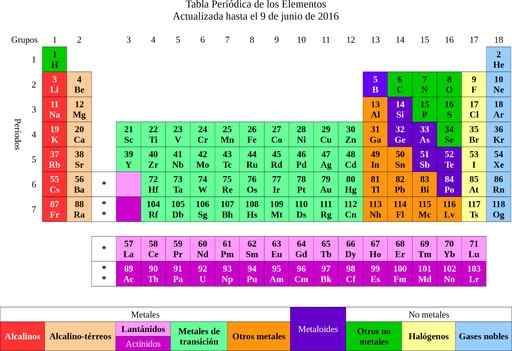 Slika 2. periodična tabela elementov. Vir: Wikimedia Commons.
Slika 2. periodična tabela elementov. Vir: Wikimedia Commons. Iz elementov je šlo na idejo o atomih, besedo, ki pomeni nedeljivo. Kmalu kasneje so znanstveniki opazili, da imajo atomi strukturo. Poleg tega so imeli atomi dve vrsti električnega naboja (pozitivno in negativno).
Subatomski delci
V poskusih Rutherforda, v katerih je bombardiral atome tanke zlate plošče z alfa delci, je bila razkrita struktura atoma: majhno pozitivno jedro, obkroženo z elektroni.
Še naprej so bombardirali atome vse več energijskih delcev in jih še vedno naredili, da bi vse bolj razkrili skrivnosti in lastnosti mikroskopskega sveta.
Na ta način je bil dosežen standardni model, ki določa, da so resnični osnovni delci tisti, ki so sestavljeni atomi. Atomi posledično povzročajo elemente, te do spojin in vseh znanih interakcij (razen gravitacije). Skupno je 12 delcev.
Ti temeljni delci imajo tudi svojo periodično tabelo. Obstajata dve skupini: fermionski delci spin ½ in bozonic. Bozonic so odgovorni za interakcije. Fermionike je 12 in so tiste, ki povzročajo protone, nevtrone in atome.
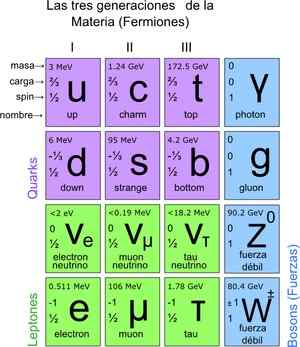 Slika 3. Temeljni delci. Vir: Wikimedia Commons.
Slika 3. Temeljni delci. Vir: Wikimedia Commons. Kako prešteti delce na mikroskopski lestvici?
Sčasoma so kemiki odkrili relativne mase elementov iz natančnih meritev v kemičnih reakcijah. Na primer, lahko bi lahko ugotovili, da je ogljik 12 -krat težji od vodika.
Prav tako je bilo ugotovljeno, da je vodik najlažji element, tako da je bil ta element dodeljen relativni masi 1.
Po drugi strani kemikalije, ki morajo vedeti število delcev, ki sodelujejo v reakciji, tako da nobenega reagenta ne manjka. Na primer, molekula vode zahteva dva atoma vodika in en kisik.
Vam lahko služi: valoviti pojaviIz teh ozadja se rodi koncept mol. En mol katere koli snovi je fiksna količina delcev, enakovredna molekularni ali atomski masi v gramih. Tako je bilo ugotovljeno, da ima 12 gramov ogljika enako število delcev kot 1 gram vodika. Ta številka je znana kot Avogadro številka: 6,02 x 10^23 delcev.
-Primer 1
Izračunajte, koliko zlatih atomov je v 1 gramu zlata.
Rešitev
Znano je, da ima zlato atomsko težo 197. Te podatke najdemo v periodični tabeli in kaže, da je zlati atom 197 -krat težji od enega vodika in 197/12 = 16.416 -krat težji od ogljika.
Zlati mol ima 6,02 × 10^23 atomov in ima atomsko težo, izraženo v gramih, torej 197 gramov.
V gramu zlata je 1/197 molov zlata, to je 6,02 × 10^23átomos/197 = 3,06 x10^23 zlatih atomov.
-Primer 2
Določite število molekul kalcijevega karbonata (CACO3) da je v 150 gramih te snovi. Povejte tudi, koliko atomov kalcija, koliko ogljika in koliko kisika je v tej spojini.
Rešitev
Prva stvar je določiti molekulsko maso kalcijevega karbonata. Periodična tabela kaže, da ima kalcij molekulsko maso 40 g/mol, ogljik 12 g/mol in kisik 16 g/mol.
Nato molekularna masa (caco3) biti:
40 g/mol + 12 g/mol + 3 x 16 g/mol = 100 g/mol
Vsakih 100 gramov kalcijevega karbonata je 1Mol. Potem v 150 gramih ustreza 1,5 mola.
Vsak mol karbonata ima 6,02 x 10^23 karbonatnih molekul, tako da je v 1,5 moli karbonata 9,03 x 10^23 molekul.
Če povzamemo, v 150 gramih kalcijevega karbonata obstajajo:
- 9,03 x 10^23 molekule kalcijevega karbonata.
- Kalcijevi atomi: 9,03 x 10^23 .
- Tudi 9,03 x 10^23 ogljikovih atomov
- Končno 3 x 9,03 x 10^23 atomi kisika = 27,09 x 10^23 atomi kisika.
Reference
- Uporabna biologija. Kakšni so mikroskopski ukrepi?. Obnovil od: YouTube.com
- Kemična izobrazba. Makroskopske, submikroskopske in simbolične predstavitve o snovi. Okreval od: scielo.org.mx.
- Garcia a. Tečaj interaktivne fizike. Makrostate, mikrostate. Temperatura, entropija. Pridobljeno iz: sc.Ehu.je
- Mikroskopska struktura snovi. Okreval od: Alipso.com
- Wikipedija. Mikroskopska raven. Okreval od: Wikipedia.com

