Pauling lestvica

- 678
- 74
- Adrian Legros
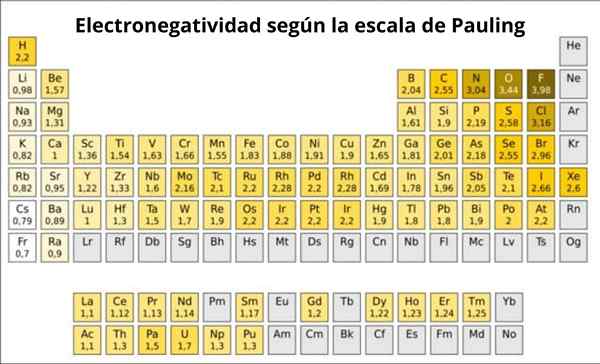 Slika 1. Pauling lestvica. Vir: Wikimedia Commons.
Slika 1. Pauling lestvica. Vir: Wikimedia Commons. Kaj je Pauling lestvica?
The Pauling lestvica To je poljubna lestvica, ki se uporablja v kemiji za izražanje Elektronegativnost elementov. To je opredeljeno kot težnja določenega atoma, da privabi elektrone v kombinaciji z drugim atomom.
V tem smislu visoki elementi elektronegativnosti zlahka pridobivajo elektrone. To so ne -komele, medtem ko je manj elektronegativnih elementov, kot so kovine, lažje dajejo elektrone.
Zato ima poznavanje elektronegativnosti elementa predstavo o vrsti povezave, ki se lahko oblikuje v kombinaciji z drugim. To bomo videli s številčnim primerom kasneje.
S temi informacijami lahko napovedujete številne lastnosti, ki jih bo imela spojina, nekaj zelo koristnega v eksperimentalni kemiji in za znanost o materialih, kjer se nenehno ustvarjajo nove spojine.
Vendar je priročno razjasniti, da kljub temu, kako pomembno je, ni edinstvenega načina določanja elektronegativnosti; Pauling lestvica je le ena izmed različnih oblik, predlaganih, da jo najde, čeprav je ena najbolj uporabljenih.
Pravzaprav je Pauling's poljubna lestvica, v kateri je vsakemu elementu periodične tabele dodeljena numerična vrednost, ki odraža njegovo elektronegativnost. Vidimo ga na sliki 1, kjer imate elektronegativnost vsakega elementa, kot je dodelila dvakrat Nobelova nagrada Linus Pauling (1901-1994) okoli leta 1939.
Elektronegativnost elementov
Pauling, poleg Don M. Yost, vrednosti elektronegativnosti je našel empirično, z eksperimentalnimi podatki, ki jih dobimo z merjenjem energije povezave.
Pauling, dodeljen fluoru.0. Torej, ko se fluoridne oblike povežejo, ima najvišji trend za privabljanje elektronov med vsemi elementi.
Lahko vam služi: Koordinacijska številka: kaj je, izračun, primeriDrugi je kisik, s 3.5 in tretja je dušik s 3.0. Oba sta zgoraj in desno od mize.
Po drugi strani je na nasprotnem koncu najmanj elektronegativni element cezij, katerega simbol je CS, ki se nahaja na levi strani mize, ki je Pauling dodelil številko 0.7.
Elektronegativnost v periodični tabeli
Na splošno in kot je prikazano na sliki 1, se v periodični tabeli povečuje elektronegativnost - in ionizacijska energija - narašča z leve proti desni. Splošni trend kaže tudi na zmanjšanje pri premikanju od zgoraj navzdol.
Zato jih bodo imeli najbolj elektronegativni elementi pod zgornjim desnim kotom tabele: fluor, kisik, klor, dušik. Najmanj elektronegative -ali najbolj elektropozitivni, če so prednostne-.
V vsakem stolpcu se elektronegativnost zmanjšuje s povečanjem atomskega števila elementa, razen v prehodnih kovinah v središču, ki ne sledijo temu trendu.
Pomembna točka, ki jo je treba poudariti, je, da je elektronegativnost relativna, ni nespremenljiva lastnost vsakega elementa in se meri samo glede na lastnosti drugih elementov. Veliko je odvisno od stanja oksidacije, tako da lahko isti element kaže drugačno elektronegativnost, odvisno od vrste spojine, ki tvori.
Povezava Energy razlika
 Slika 2. Ameriški kemik Linus Pauling leta 1955. Vir: Wikimedia Commons.
Slika 2. Ameriški kemik Linus Pauling leta 1955. Vir: Wikimedia Commons. V kemiji je povezava način, kako se atomi združijo, enaki ali drugačni, da tvorijo molekule. Med atomi so sile, ki jih ohranjajo stabilne.
Obstaja več vrst povezav, vendar sta tu obravnavani dve:
- Kovalentna, v katerem atomi podobnih elektronegativnosti delijo nekaj elektronov.
- Ionska, pogosto med atomi z različnimi elektronegativnostmi, v katerih prevladuje elektrostatična privlačnost.
Recimo, da lahko dva elementa A E B tvorita molekule med seboj, označena z AA in BB. In se lahko tudi pridružijo, da oblikujejo AB spojino, vse skozi neko vrsto povezave.
Zahvaljujoč sodelovanju medmolekularnih sil je v povezavi energija. Na primer, energija v povezavi AA je eAa, V povezavi BB je EBB in končno v sestavljanju AB je EAb.
Če bo molekula AB oblikovala kovalentna vez, je teoretično energija povezave povprečje energij inAa in eBb:
InAb = ½ (eAa + InBb)
Pauling izračunano eAb Za več spojin ga je eksperimentalno izmeril in določil razliko med obema vrednostma, ki sta jo poimenovala δ:
Δ = | (eAb) izmerjeno - (eAb) Teoretična | = | (EAb) izmerjeno - ½ (eAa + InBb) |
Pauling je utemeljil takole: če je Δ zelo blizu 0, to pomeni, da so elektronegativnosti obeh elementov podobne in povezava, ki jih združuje. Če pa Δ ni majhen, potem povezava med A in B ni čista kovalentna.
Večja kot je absolutna vrednost δ, večja je razlika med elektronegativnostjo elementov A in B, zato je povezava, ki jo bo UNE unle ionskega tipa. Kasneje bo bralec našel primer, v katerem je, če izračunamo δ, mogoče določiti vrsto povezave spojine.
Enačbe za elektronegativnost
Začenši od dejstva, da je razlika v energiji signal, ki razlikuje naravo povezave, je Pauling naredil številne poskuse, zaradi katerih je ustvaril empirični izraz za relativne elektronegativnosti dveh elementov, ki tvorijo molekulo, ki tvorijo molekulo.
Z označevanjem takšne elektronegativnosti, kot je χ (grška črka "chi"), je Pauling opredelil δ na naslednji način:
F2· Δ = [χ (a) - χ (b)]2
χ (a) - χ (b) = f√δ = 0.102√δ
Vam lahko služi: Tanteo ravnovesje: koraki, primeri in vajeUpoštevajte, da je Δ pozitiven znesek. Fatia f = 0.102, ki se zdi, da se pomnoži kvadratni koren Δ.
Če se namesto tega uporabljajo kilokalororije in elektronski volti.208:
χ (a) - χ (b) = 0.208 stene
Pauling je začel dodeliti vodik vrednosti 2.1, prejšnja vrednost, ki jo je pridobil kemik Robert Mulliken. Ta element je izbral kot izhodišče, ker tvori kovalentne povezave z mnogimi drugimi.
Skozi prejšnjo enačbo je nadaljeval z dodeljevanjem vrednosti, povezanih z ostalimi elementi. Spoznal je, da se elektronegativnost poveča, ko se v periodični tabeli premika od leve proti desni in od zgoraj navzdol, kot je opisano v prejšnjem razdelku.
Primer
Spodaj je seznam elementov: N, J in M in njihove ustrezne elektronegativnosti χ v skladu s Pauling lestvico:
-N: Χ = 4.0
-J: Χ = 1.5
-In: Χ = 0.9
-M: Χ = 1.6
Med naslednjimi spojinami, ki so nastale z njimi:
Yj, yn, mn in jm
Opozorite tistega z največjim ionskim značajem in tistega, čigar narava je kovalentna. Razlog za vaš odgovor.
Rešitev
V skladu z merili, ki jih določa Pauling, bo spojina z najvišjim ionskim značajem tista z največjo razliko med elektronegativnostmi in s tem večjo vrednost δ. Svoje strani je spojina z najnižjo energijsko razliko tista, ki ima kovalentno vez.
Nato bomo izračunali, koliko je vredno δ za vsako spojino, kot sledi:
Sestavljena yj
Δ = [χ (y) - χ (j)]2 = (0.9 - 1.5)2 = 0.36
Yn spojina
Δ = [χ (y) - χ (n)]]2 = (0.9 - 4.02 = 9.61
Spojina mn
Δ = [χ (m) - χ (n)]2 = (1.6 - 4.02 = 5.76
JM spojina
Δ = [χ (j) - χ (m)]2 = (1.5 - 1.6)2 = 0.01
Iz zgornjih rezultatov izhaja, da je spojina ionskega značaja YN, katerega Δ = 9.61, medtem ko je spojina kovalentnega znaka JM z Δ = 0.01.

