Ravnotežje s tekočino-hlapom

- 2187
- 487
- Adrian Legros
Kaj je ravnovesje med tekočino in hlapom?
On Ravnotežje s tekočino-hlapom To je dinamično stanje, ki vzpostavlja tekočino, naj bo čista snov ali mešanica, s paro, ki obdaja in sodeluje s svojo površino. Če se želite zgoditi, mora biti posoda zaprta, sicer bi zračni tokovi povzročili, da tekočina počasi izhlapi.
Ko je sistem zaprt, se bo tlak, ki ga izvajajo molekule parne faze, vzpenjal s časom. Točka bo prišla tam, kjer se bo pritisk ustavil; To je parni tlak tekočine, ki je fizična lastnost zadeve, neodvisna od velikosti posode ali količina tekočine.
 Ko je plinska pijača odkrita, je moteno njegovo tekočino-hladno ravnovesje, kar povzroči neravnovesje tlakov zunaj in znotraj steklenice, z njo. Vir: OpenStax, CC do 4.0, prek Wikimedia Commons
Ko je plinska pijača odkrita, je moteno njegovo tekočino-hladno ravnovesje, kar povzroči neravnovesje tlakov zunaj in znotraj steklenice, z njo. Vir: OpenStax, CC do 4.0, prek Wikimedia Commons Vsaka tekočina, čista ali mešana, bo imela povezan parni tlak, ki bo odvisen od nestanovitnosti njegovih komponent; In zato medmolekulskih sil, ki jih držijo skupaj znotraj tekočine in na njihovi površini.
Ta pritisk je mogoče opisati s predpostavko idealnosti raztopin ali mešljivosti sestavnih delov mešanice. Če želite to narediti.
Ravnotežje s tekočino-hlapom je ključnega pomena za neskončnosti procesov kemijskega inženirstva, kot so deskalne destilacije in tiste, narejene z vodno paro, skozi katere se destilirajo v najbolj hlapnih komponentah. To je primer etanola pri 95.4% v vodi, ki je najbolj dostopen in ekonomičen odstotek alkohola na trgu.
Čiste snovi
Molekule čiste snovi še vedno niso, vendar se premikajo iz enega kraja v drugo, zahvaljujoč lastni kinetični energiji. Ta energija je včasih lahko dovolj velika, da premaga medmolekularne sile, ki "potegnejo" molekulo iz posebne v krog tekočine. Nato bo molekula pobegnila s površine tekočine do parne faze.
V fazi pare se molekule trčijo v notranje stene vsebnika, zmagajo ali izgubljajo hitrost, dokler se ne ponovno združijo s površino tekočine, kjer bodo enkrat vključili konglomerat molekul tekoče faze.
Vam lahko služi: kobalt: struktura, lastnosti, aplikacijeTako traja čas, dokler pri določeni temperaturi (recimo 25 ° C), število molekul, ki pobegnejo od površine. Zato se reče, da je bila v čisti snovi vzpostavljena v ravnovesju med tekočino.
Parni tlak za doživetje notranjih sten posode in površine tekočine bo enak PDoº, ki je konstantna in ponovljiva; Ne glede na to, kako velika ali majhna je posoda, niti prostornina tekočine.
Mešanice
V tekočih mešanicah bo tudi komponenta, ki izvaja pritisk na površino tekočine in kontori. Vaš parni tlak, kot je mogoče pričakovati, bo sestavljen iz prispevkov iz vsake komponente mešanice, če rečem, dve snovi A in B. Te mešanice so lahko mešave, delno mešljive.
Merljiv
V mešani mešanici med A in B obe snovi sestavljata eno fazo, ki je na prvi pogled videti kot čista snov. Tako bo po Daltonovem zakonu pritisk mešanice ali raztopine enak:
Strsonce = PDo + StrB +··· PYo
Biti pYo katero koli drugo komponento, ki je prisotna tudi v mešanici. Upoštevajte, da strDo≠ pDoº, torej pritiski snovi v mešanici niso enaki tistim v njihovih stanjih z visoko čistostjo.
Ob predpostavki, da je rešitev idealna, so razlike med interakcijami A-A, B-B in A-B očitne. To lahko na primer uporabimo v mešanici etanola in metanola.
Zato bodo parni tlaki komponent v mešanici odvisni od njihovih relativnih količin v tekoči fazi, izražene kot molske frakcije xYo. In tu poseduje Raaultov zakon, ki želi povezati tlak PDo In pDoº:
StrDo = XDo StrDoº
Zdaj je skupni tlak enak:
Strsonce = XDo StrDoº + xB StrBº +···
Na drugi strani bo faza pare imela svoje sestave, izražena kot yi molarni frakciji:
Yi = strYo / Psonce
= XYo StrYoº / psonce
Binarni diagram
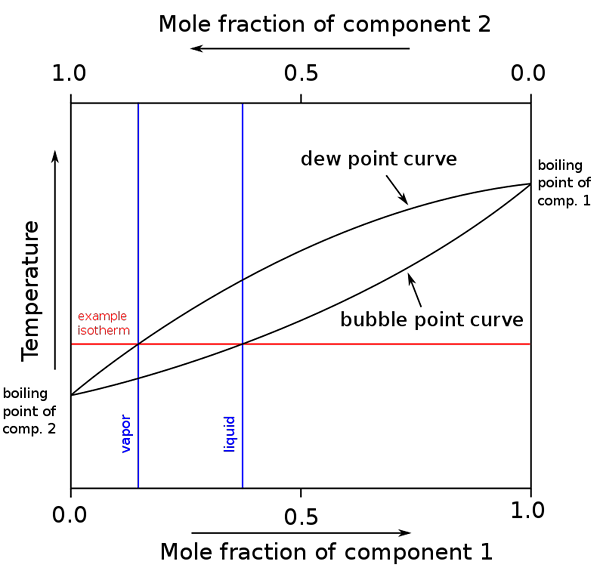 Diagram vrelišča in molarne sestave za binarno mešanico. Vir: binary_boiling_point_diagram.PNG: H Padleckasderivativno delo: Michbich, CC BY-SA 2.5, prek Wikimedia Commons
Diagram vrelišča in molarne sestave za binarno mešanico. Vir: binary_boiling_point_diagram.PNG: H Padleckasderivativno delo: Michbich, CC BY-SA 2.5, prek Wikimedia Commons Ko so molarne frakcije sestavnih delov binarne mešanice (A + B) grafične, odvisno od temperature ali tlaka, dobimo binarni diagrami (glej zgoraj). Ta posebna oblika, najpreprostejša, ustreza temu pri idealnih rešitvah.
Vam lahko služi: molarni zvezek: koncept in formula, izračun in primeriObmočje nad "ovalno" ustreza parni fazi, medtem ko območje spodaj ustreza tekoči fazi mešanice. Upoštevajte, da je molarni delež komponente 1 ali 0 (x1= 0), molarni delež komponente 2 ali B bo enak 1 (x2= 1), nato pa parni tlak dolguje samo b. Ta temperatura postane vrelišče B.
Medtem na drugem koncu (desno), ko x2= 0 ampak x1= 1, parni tlak je samo. Ta temperatura postane njena vrelišče.
Spodnja ovalna črta ustreza točki mehurčkov, ki je takrat, ko se pojavi prvi mehurček, ko se segreva tekoča zmes (po diagramu navzgor). In zgornja črta ustreza točki rosa, to je takrat, ko se parna faza ohladi in se pojavi prvi kapljica (na diagramu se spusti).
Azeotropos
V mnogih ne -idealnih rešitvah bomo imeli azeotrops, ki so mešanice, ki izhlapijo, da ohranijo svojo sestavo konstantno; to pomeni, da izhlapijo, kot da so čista spojina.
Nemogoče je "prekiniti" azeotropsko sestavo z več koraki destilacije. Namesto tega se uporabljajo druge metode za povečanje čistosti želene komponente.
Na primer, mešanica etanol-voda tvori azeotropno z 95 sestavo.4 etanola. To pomeni, da je z destilacijami nemogoče pridobiti etanol s koncentracijo, večjo od 95.4%; Vedno jih bo 4.6% preostale vode. Če bi želeli pripraviti absolutni etanol (100%), bi bilo treba uporabiti dehidralno materiale ali druge poti sinteze.
V binarnem diagramu lahko vidimo prisotnost azeotropa, ki predstavlja naslednjo obliko:
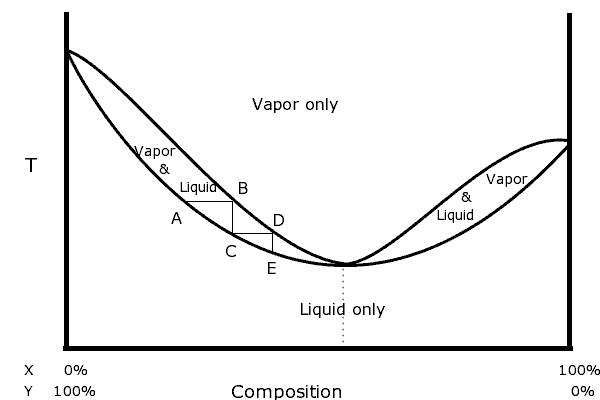 Binarni diagram mešanice s pozitivnim azeotropskim. Vir: Karlhahn v angleški Wikipediji, javna domena, prek Wikimedia Common
Binarni diagram mešanice s pozitivnim azeotropskim. Vir: Karlhahn v angleški Wikipediji, javna domena, prek Wikimedia Common Na levi strani diagrama je razvidno, da lahko znotraj "ovalnega", regije, kjer imamo ravnovesje med tekočino-hlapom, destiliramo v zaporednih korakih (a, b, c, d in e), da dobimo čedalje bolj bogato Mešanica v najbolj hlapni komponenti (x za ta diagram).
V azeotropni točki pa mešanica x in y in vreli, kot da bi bila ena sama snov, zato ni pomembno, koliko destilacij imata tako tekočina kot para enake sestave.
Vam lahko služi: molekularna formula: kako jo izvleči, primeri in vajeDelno mešan
V delno mešanih mešanicah se bodo oblikovale, odvisno od temperature, dve prepoznavni fazi: ena bogata s komponento A, in druga bogata s komponento B. Binarni diagrami za te primere so veliko bolj strogi in široki, saj vključujejo regije, kjer parna sobiva skupaj z obema fazama.
Neizmerno
Ko govorimo o neizmernih mešanicah, se bo vsaka komponenta obnašala, kot da bi bila v stanju visoke čistosti, saj komaj komunicira z drugimi molekulami. Zato bo tlak pare za te mešanice enak:
Strsonce = PDoº + pBº +··· PYoº
Mešanica bo zavrela pri temperaturi nižjo kot pri čistih komponentah, ker bo tlak nemirbitne mešanice višji, saj je enak vsoti tlakov vsake komponente v svojem čistem stanju. Več tlaka pare pomeni, da je bolj hlapna, zato bo zavrela pri nižji temperaturi.
Prijave
Destilacije
Pri destilacijah, zlasti na industrijski ravni. Iz sestavnih delov mešanice in njegovih faznih diagramov je mogoče izračunati, koliko jedi je potrebnih pri konstrukciji stolpa frakcioniranja za pravilno ločevanje omenjenih komponent.
Destilacija vodne pare
Vodno paro lahko pod destilacijo črpate v mešanici. Pri mehurčku vodne pare znotraj tekočine se bo povečal tlak v mešanici, tako da bo zavrela pri nižji temperaturi in pomagala pridobiti najbolj hlapne komponente (na primer esence).
Pitje ptice
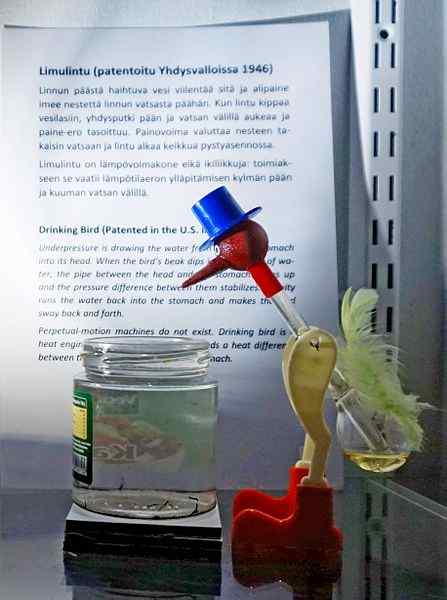 Pitje ptice, ena najbolj domiselnih igrač vseh časov. Vir: Tiia Monto, CC BY-SA 4.0, prek Wikimedia Commons
Pitje ptice, ena najbolj domiselnih igrač vseh časov. Vir: Tiia Monto, CC BY-SA 4.0, prek Wikimedia Commons Čeprav ni ravno ravnovesje tekočine in hlapov, je resnica, da se za operacijo pitja ptice skriva več termodinamičnih pojavov.
Ko je ptičasta glava mokra, se začne ohladiti, ko voda izhlapi. To znižanje temperature povzroči znižanje tlaka znotraj ptičje glave. Metilen klorid, ki se nahaja na dnu ptice, si bo prizadeval uravnotežiti pritiske, ki teče skozi stekleno cev, ki povezuje glavo z glavo.
Tekočina se bo dvignila do ptičje glave, zaradi česar je težja in nagiba svoje telo naprej. Ptica nato "pije vodo" in parni pritiski se bodo uravnotežili. Uravnoteži pritiske, ptica ptice se bo vrnila v navpični položaj in cikel se bo ponovil, medtem ko voda glave spet izhlapi.
Reference
- Whitten, Davis, Peck & Stanley. (2008). Kemija. (8. izd.). Cengage učenje.
- Walter J. Moore. (1962). Fizikalna kemija. (Četrta izdaja). Longmans.
- Wikipedija. (2020). Ravnotežje hlapov-tekočine. Pridobljeno iz: v.Wikipedija.org
- Ed Vitz in sod. (5. november 2020). Ravnotežje hlapov-tekočine. Kemija librettexts. Okrevano od: kem.Librettexts.org
- Limer Eric. (30. januar 2018). Nesmiselno podrobna razlaga igrače za pitje ptic. Okrevano od: popularmechanics.com
- Univerza v Alicanteu. (s.F.). Tema 4: Izračun ravnotežja. Ravnotežni diagrami. [PDF]. Okreval od: rua.Ua.je

