Entalpía
- 1872
- 362
- Dexter Koch
Kaj je entalpija?
The entalpía Gre za termodinamično lastnost, katere nihanje v konstantnih temperaturnih in tlačnih pogojih določa kalorično energijo snovi ali sistema, povezane s kemično reakcijo ali fizikalnim procesom. Ker je državna funkcija, je predstavljena s črko v kapitalu H, saj je Δh njena variacija.
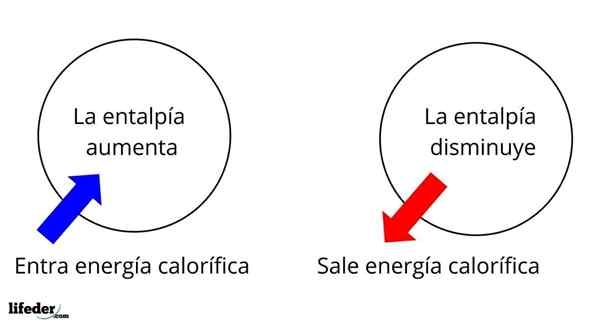
Je ena najbolj temeljnih obsežnih lastnosti za preučevanje termokemije številnih reakcij; to pomeni, da govorimo o ločitvi ali absorpciji toplote med medijem reakcije in okolico. Tako pravimo, da je reakcija eksotermična, če je njen ΔH negativen (ΔH 0).
 Sprememba entalpije pri taljenju ledu je pozitivna, kar kaže, da led absorbira toploto iz okolja, da se premakne v tekočino, vodo
Sprememba entalpije pri taljenju ledu je pozitivna, kar kaže, da led absorbira toploto iz okolja, da se premakne v tekočino, vodo Na primer, led ima entalpijo, hled, Medtem ko ima voda tudi svojo entalpijo, hvoda. Ko se led topi, pride do sprememb entalpije, imenovane ΔHFus ali topna toplota (hvoda-Hled). Entalpija vode je boljša od ledu, kar povzroča ΔHFus Za led je pozitiven in ima +6 vrednost.01 kJ/mol.
Entalpija in njena variacija se običajno izražajo v enotah Joule ali kalorij. Sprememba entalpije +6.01 kJ/mol kaže, da mora ledeni mol absorbirati 6.01 kJ kalorične energije ali toplote za taljenje.
Kako se izračuna entalpia?
Entalpija in njena variacija
Entalpija sama po sebi je neprecenljiva, ker je odvisna od spremenljivk, ki jih je težko natančno izmeriti. Dobra primerjava bi bila, da bi želeli izmeriti skupno količino oceanov: vedno bodo deli pod zemljo ali raztreseni med celinami. Zato in v praksi h ni mogoče določiti; Ampak ja ΔH.
Vam lahko služi: koloidDa bi dosegli matematični izraz, ki omogoča izračun ΔH, mora biti najprej ostalo od temeljne definicije entalpije:
H = u + pv
Ker je notranja energija sistema ali zadevne snovi, in pv delovno volumen, ki ga ta sistem izvaja na okolici. Ker nas zanima izračun ΔH in ne H, imamo:
ΔH = ΔU + Δ (PV)
Če je tlak konstanten, bo enačba ostala:
ΔH = ΔU + PΔV
Po drugi strani vemo, da:
ΔU = q + W
Biti q Vročina in W deluje. Nadomestitev nas:
ΔH = q + W + PΔV
Poleg tega pa to vemo:
W = - pΔv
In zato:
ΔH = q - PΔV + PΔV
ΔH = q
To pomeni, da bo ΔH za reakcijo ali postopek, ki se izvaja pod konstantnim tlakom q ustvarjena ali absorbirana.
Reakcije Entalpija se spreminja
Predpostavka, da tlak ostane konstanten, je mogoča, če se reakcija pojavi pod zemeljsko atmosfero. Na primer, led zimskih pokrajin se topi, ne da bi doživel še en pritisk kot v našem ozračju. Po drugi strani velja tudi za reakcije v tekočih medijih ali tistih, ki ne proizvajajo velikih količin plinov.
Te reakcije absorbirajo ali sproščajo toploto q Enako ΔH, kar posledično je razlika v entalpijah med produkti in reaktanti:
ΔH = HIzdelki - HReaktanti
Vrste entalpije
Običajna praksa je govoriti o ΔH in h, kot da sta enaka: oba se imenujeta entalpije. Ko pa gre za vrste, je H edinstven za vsako snov ali sistem; Medtem ko je ΔH na drugi strani podvržen naravi reakcije ali procesa sama po sebi.
V tem smislu imamo najprej pozitivne razlike v entalpiji (ΔH> 0) ali negativne (ΔH <0); unas corresponden a los procesos o reacciones endotérmicos (se enfrían los alrededores), mientras las segundas tienen que ver con los procesos o reacciones exotérmicos (se calientan los alrededores).
Lahko vam služi: nitrobenzen (C6H5N2): struktura, lastnosti, uporabe, tveganjaZnak '+' ali '-', ki spremlja ΔH, nam pravi, če je v določeni reakciji ali postopku osvoboditev ali absorpcija toplote; ki imajo svoje značilnosti ΔH kot del svojih termokemičnih lastnosti.
Imamo neskončnosti vrst entalpij, ki jih je mogoče razvrstiti v skladu s fizikalnimi procesi ali kemičnimi reakcijami.
Fizični procesi
Fazna sprememba entalpije
Snovi morajo absorbirati ali sprostiti toploto, da se premikajo iz materialne ali materialne faze (trdna, tekočina ali plin) na drugega. Na primer, led absorbira toploto, da se tali, zato entalpija za to fazno spremembo ustreza fuziji, ΔHFus, Imenuje se tudi latentna toplotna toplota.
Entalpija raztapljanja ali mešanice
Snovi, ko se raztopijo ali mešajo v mediju topila, lahko absorbirajo ali sprostijo toploto, s čimer imajo entalpijo ΔHDis ali ΔHMešanica.
Kemične reakcije
Trening entalpija
To je povezana toplota, ΔHºF, na tvorbo spojine, zlasti enega mola, iz njegovih sestavnih elementov v standardnih pogojih tlaka in temperature (t = 298.15 K in P = 1 atm).
Razgradnja entalpija
Je povezana toplota, ΔHdes, na razgradnjo spojine v manjših in preprostih snovi. Na splošno je pozitiven, ker je potrebna toplota za prekinitev vezi molekul.
Entalpija hidrogenacije
Je povezana toplota, ΔHh, Za odvisnost od vodikove molekule do spojine, običajno ogljikovodika.
Entalpija zgorevanja
To je toplota, ΔHglavnik, Ko snov gori, reagira s kisikom. Je negativno, ker se sproščata toplota in svetloba (ogenj).
Lahko vam služi: atomska masa: definicija, vrste, kako jo izračunati, primeriPrimeri entalpij
Končno bo omenjena nekatere posebne primere entalpije:
Izgorevanje metana
Pogl4 + 22 → co2 + 2H2Tudi
ΔH = -890.3 kJ/mol
To je en mol Cho4 Ko zgorevanje osvobodi 890.3 kJ kalorične energije.
Hidrogenacija etilena
Pogl2= Pogl2 + H2 → pogl3Pogl3
ΔH = -136 kJ/mol
Mol etilena sprošča 136 kJ toplote, ko vodik postane etan.
Sol v vodi
Namizna sol, NaCl, se raztopi v vodi, da loči ione NA+ in Cl- kristalnih omrežij in obkroža (hidrat) molekul vode:
NaCl (S) → NA+(AC) + Cl-(AC)
ΔH = +3.87 kJ/mol
To pomeni, da raztapljanje soli v vodi, v skladu s tem ohladi kozarec ali posodo. Vendar je absorbirana količina toplote zelo majhna, zato bodo naše roke občutile le rahlo spremembo temperature.
Raztapljanje kalijevega klorata v vodi
Po drugi strani pa kalijev klorat, kclo3, Ima ΔHDis zelo pozitivno:
KCl3(s) → k+(AC) + CLO3-(AC)
ΔH = +41.38 kJ/mol
Kar pomeni, da se raztopi v vodi, ki absorbira zelo vroče. In zato se bo posoda znatno ohladila in videli bomo, da bo okoliška vodna para navlažila svojo zunanjo površino.
Reference
- Whitten, Davis, Peck & Stanley. (2008). Kemija. (8. izd.). Cengage učenje.
- Wikipedija. (2020). Entalpija. Pridobljeno iz: v.Wikipedija.org
- Čelada, Anne Marie, ph.D. (28. avgust 2020). Opredelitev entalpije v kemiji in fiziki. Okreval od: Thoughtco.com
- Andrew Rader Studios. (2015). Energija in entalpija. Okrevano od: fizika 4Kids.com
- Kiddle. (2020). Entalpijska dejstva za otroke. Pridobljeno iz: dejstva.Kiddle.co
- Admin. (21. december 2010). Entalpija. Okrevano od: oksiorganska kemikalija.com
- María Estela Raffino. (11. julij 2020). Koncept entalpia. Okrevano od: koncept.od

