Pi povezava
- 791
- 207
- Stuart Armstrong
Pojasnjujemo, kaj je povezava PI, kako se oblikujejo njene značilnosti, in navedemo več primerov
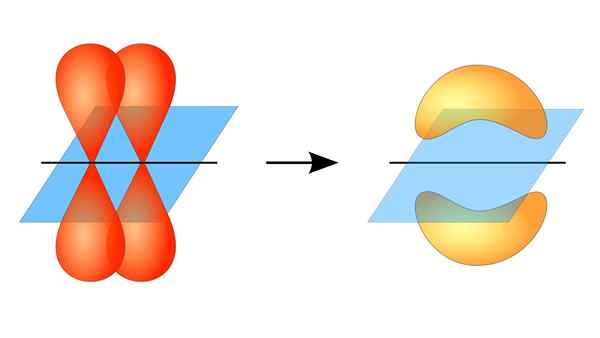
 Dve orbitali P tvorita povezavo π
Dve orbitali P tvorita povezavo π Kaj je povezava PI?
A Pi povezava (π) To je kovalentna vrsta povezave, za katero je značilna preprečevanje gibanja prostih vrtenja atomov in izvira med parom čistih atomskih orbitalov, med drugimi posebnostmi. Obstajajo povezave, ki jih lahko med atomi oblikujejo svoje elektrone, ki jim omogočajo, da zgradijo večje in bolj zapletene strukture: molekule.
Te povezave so lahko različnih sort, vendar so najpogostejše na tem študijskem področju. Kovalentne vezi, imenovane tudi molekularna, so vrsta povezave, kjer vpleteni atomi delijo pare elektronov.
To se lahko pojavi zaradi potrebe, da atomi iščejo stabilnost in tako tvorijo večino znanih spojin. V tem smislu so kovalentne vezi lahko preproste, dvojne ali potrojene, odvisno od konfiguracije njihovih orbitalov in količine elektronskih parov, ki jih delijo med vključenimi atomi.
Zato obstajata dve vrsti kovalentne vezi, ki se tvorita med atomi, ki temeljijo na orientaciji njihovih orbital: povezave sigma (σ) in pi (π) povezave (π).
Pomembno je razlikovati obe povezavi, saj je povezava Sigma predstavljena v preprostih sindikatih in PI v več sindikatih med atomi (dva ali več elektronov se deli).
Kako je z obrazci PI povezave?
Da bi opisali oblikovanje povezave PI, je treba najprej razpravljati o postopku hibridizacije, saj se vmeša v nekatere pomembne povezave.
Hibridizacija je postopek, pri katerem se oblikujejo hibridne elektronske orbitale; to je, kjer je mogoče atomske sub -ravne orbitale s in p zmešati. To povzroča nastanek SP, SP orbitale2 in sp3, ki se imenujejo hibridi.
Vam lahko služi: reverzibilna reakcija: značilnosti in primeriV tem smislu se nastajanje povezav PI pojavi zahvaljujoč prekrivanju parih reženj, ki pripadajo atomski orbitali na drugem paru reženj, ki so v orbitali, ki je del drugega atoma.
To orbitalno prekrivanje se pojavi bočno, zato je elektronska porazdelitev koncentrirana večinoma nad in pod ravnino, ki tvorijo povezana atomska jedra, in povzroči, da so PI vezi šibkejše od sigma vezi.
Ko govorimo o orbitalni simetriji te vrste zveze, je treba omeniti, da je enak tistemu pri P orbitali tipa P, dokler jo opazimo skozi osi, ki jo tvori povezava. Poleg tega te sindikate večinoma sestavljajo Orbitals P.
Tvorba vezi v različnih kemičnih vrstah
Ker PI vezi vedno spremljata še ena ali dve povezavi (ena sigma ali druga pi in ena sigma), je pomembno vedeti, da je dvojna vez, ki nastane med dvema ogljikovih atomih (sestavljena iz sigma vezi in ena PI) ima nižjo energijo povezave kot tista, ki ustreza dvakratni povezavi sigma med obema.
To je razloženo s stabilnostjo sigma povezave, ki je večja od vezi PI, ker se prekrivanje atomskih orbitalov v slednjem pojavi vzporedno v območjih zgoraj in pod režnja jedra.
Kljub temu, ko povezave Pi in Sigma združijo več glasnejših povezav kot preprosta povezava, ki jo je mogoče preveriti z opazovanjem dolžin povezav med različnimi atomi s preprostimi in večkratnimi povezavami.
Vam lahko služi: ne -metalni oksidiObstaja nekaj kemijskih vrst, ki jih preučuje njihova izjemno vedenje, na primer koordinacijske spojine s kovinskimi elementi, v katerih so osrednje atome združene le s PI vezi.
PI značilnosti povezave
Ne dovoljuje gibanja prostih vrtenja atomov
Značilnosti, ki razlikujejo povezave PI od drugih vrst interakcij med atomskimi vrstami. Zaradi tega, če pride do vrtenja atomov, pride do razpada vezi.
Prekrivanje med orbitali z dvema vzporednima regijama
Prav tako se v teh povezavah prekrivanje med orbitali zgodi skozi dve vzporedni regiji, zaradi česar imajo večjo difuzijo kot sigma vezi in da so zaradi tega šibkejši.
Med nekaj čistimi atomskimi orbitali
Po drugi strani pa je, kot že omenjeno, pi povezava vedno ustvarjena med pari čistih atomskih orbitalov; To pomeni, da nastane med orbitali, ki niso utrpeli hibridizacijskih procesov, v katerih je gostota elektronov večinoma koncentrirana nad in pod ravnino, ki jo tvori kovalentna unija.
V tem smislu je med nekaj atomi mogoče predstaviti več kot eno povezavo PI, ki jo vedno spremlja povezava Sigma (v dvojnih vezih).

Podobno lahko daste trojno povezavo med dvema sosednjima atomama, ki ju tvorita dve PI vezi v položajih, ki tvorijo pravokotne ravnine med seboj, in sigma povezavo med obema atomama.
Vam lahko služi: huminska kislina: struktura, lastnosti, pridobivanje, uporabePrimeri Pi povezav
Molekula etilena
Kot je bilo že omenjeno, imajo molekule, ki jih združeni atomi sestavljajo ena ali več PI vezi vedno več povezav; to je dvojno ali trojno.
Primer tega je molekula etilen (H2C = pogl2), ki jo sestavlja dvojna zveza; To pomeni, da je Pi in ena sigma vez med atomi ogljika poleg sigma vezi med ogljikovo in vodiki.
Molekula acetilena
Molekula acetilena (H-Cdajo-H) ima trojno povezavo med atomi ogljika; to pomeni, da dve PI vezi, ki tvorita pravokotne ravnine in sigma vez, poleg ustreznih vezi ogljikovega vodika.
Benzen in derivati
Predstavljene so tudi PI vezi med cikličnimi molekulami, kot je benzen (c6H6) in njene derivate, katerih dispozicija povzroči učinek, imenovan resonanca, ki omogoča, da se elektronska gostota med drugim seli med atomi in dodelitev, večjo stabilnost spojine.
Dikarbon
Za prikaz prej omenjenih izjem, primeri dikarbonske molekule (C = C, v katerih imata oba atoma par seznanjenih elektronov) in koordinacijsko spojino, imenovano hexacarbonindihierro (predstavljena kot vera2(Co)6, ki tvorijo samo pi povezave med svojimi atomi).

