Trojna kovalentna vez
- 3469
- 1049
- Cary Goyette
Pojasnjujemo, kaj je trojna povezava, njene značilnosti in dajemo več primerov
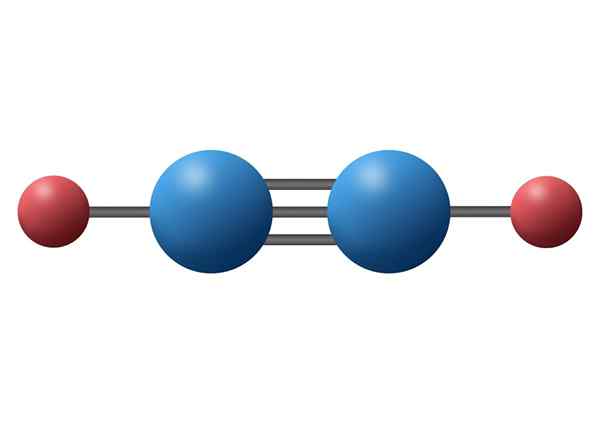 Acetilen molekula (C2H2) s svojo trojno vezjo med dvema atoma ogljika
Acetilen molekula (C2H2) s svojo trojno vezjo med dvema atoma ogljika Kaj je trojna kovalentna povezava?
The Trojne kovalentne obveznice So kemične povezave, v katerih imata dva atoma tri pare elektronov. Z drugimi besedami, to so kovalentne vezi, ki jih tvori skupno šest valenčnih elektronov, ki se vrtijo okoli dveh atomov.
Obstaja veliko kemičnih spojin, ki vsebujejo trojne povezave. Na primer, organske spojine, kot so alkini, vsebujejo trojne C-C kovalentne vezi. Za nitrile je značilno tudi, da ima skupina, ki vsebuje ogljik, povezan z dušikom s pomočjo trojne kovalentne vezi C-N. Druge anorganske spojine, kot je molekularni dušik v zraku, vsebujejo tudi trojne kovalentne vezi.
Če imate 6 elektronov, ki se obrnejo na dve jedri, daje trojne povezave številne posebne značilnosti. Obe obliki molekul, ki jih vsebujejo, in kemijske reakcije, v katerih lahko sodelujejo.
Značilnosti trojnih kovalentnih povezav
Nastanejo jih 6 elektronov
Te vezi tvorijo 6 elektronov in se tvorijo, ko vsak od obeh atomov vpletena tri svoje izginule elektrone z drugim. To je razlog, zakaj se imenujejo trojne povezave, saj imajo potrojitev števila elektronov preproste kovalentne vezi.
Imajo povezavo sigma (σ) in dve pi (π) povezavi
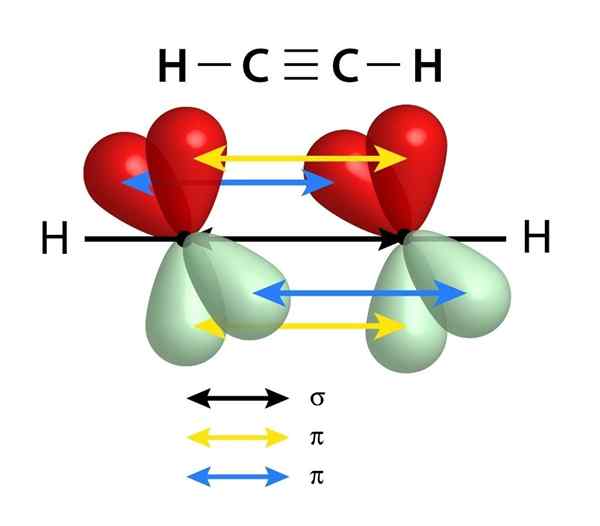 Shema povezav, ki sestavljajo trojno povezavo med dvema atoma ogljika. Črna puščica središča predstavlja povezavo Sigma, rumena in modra
Shema povezav, ki sestavljajo trojno povezavo med dvema atoma ogljika. Črna puščica središča predstavlja povezavo Sigma, rumena in modra Podobno kot dvojne vezi, tudi trojne povezave tvori tudi sigma povezava, ki poteka skozi sredino črte, ki se pridruži obema povezanimi atomi. Vendar, za razliko od dvojnih povezav, ki imajo eno, imajo trojne povezave dve povezavi PI poleg povezave Sigma.
Vam lahko služi: bakreni klorid (i) (cucl): struktura, lastnosti, uporabeSkoraj vedno tvorijo linearne spojine
Ko dva atoma ogljika tvorita trojno povezavo, ima vsak še vedno možnost oblikovanja dodatne preproste povezave z drugim atomom (saj lahko ogljik skupaj tvori 4 vezi).
V teh primerih bosta oba ogljika in druga dva atoma, pritrjena na njih. Ta oblika, ki jo molekula pridobi, se imenuje linearna geometrija.
So najmočnejše kovalentne vezi
Pri primerjavi trojnih povezav med dvema atomama z dvojnimi in preprostimi vezmi med istimi atomi opazimo, da so trojne povezave vedno močnejše od drugih vrst kovalentne vezi. To pomeni, da je težje razbiti trojno povezavo kot dvojno ali preprosto.
To je zato, ker je treba razbiti povezavo Sigma (ki je prisotna tudi v preprostih in dvojnih vezmi.
So krajše od dvojnih vezi ali preprostih
Zaradi istega dejstva, da so močnejše povezave, trojne povezave upravljajo.
Predstavljata dva nenasičenost
Vsak ogljik, ki ima trojno vez, bo imel le dodatno povezavo z drugim atomom. To pomeni, da bi bil tak ogljik povezan le z dvema atoma, namesto štirih, tako da ima manj vodika, kot bi ga lahko imel, če bi oblikoval le preproste vezi.
Vam lahko služi: Heptano (C7H16): struktura, lastnosti in uporabeTemu pravimo nenasičenost, spojine s trojnimi povezavami pa imajo dve nenasičeni, saj bi vsak od obeh ogljikov ustrezala 2 dodatni vodiki, če ne za trojno povezavo.
So toge povezave
Tako kot dvojne vezi so tudi trojne povezave toge in jih je težko upogniti ali zasukati. To je posledica večje sile povezave in na najnižji dolžini.
Lahko delujejo kot baze
Nekatere spojine s trojnimi povezavami lahko uporabijo Pi elektrone omenjene povezave za povezavo ali sprejemanje H ionov+, Zato deluje kot baze.
Lahko jih vodijo, da dajo dvojne ali preproste povezave
Nenasilnost trojne povezave lahko odstranite z razbijanjem PI vezi in dodajanjem vodikov na dva ogljika. Temu pravimo vodilno. Če bo dodana samo molekula vodika v trojno vez, bo to postala dvojna vez. Če se dodata dve molekuli vodika, bosta postala preprosta vez.
Primeri trojnih kovalentnih povezav
Dušikova molekula (n2)
Molekula dušika vsebuje trojno kovalentno vez med dvema atoma dušika. Vsak atom deli svoje tri valenčne elektrone so izginile z drugimi, vsak novi par elektronov pa postane sigma vez ali ena od dveh PI vezi, ki jih ima molekula.
 Molekula dušika
Molekula dušika V tem primeru sta dva dušikova atoma in nepoškodovani elektroni pari, ki jih je vsak od njih nameščen vzdolž ravne črte.
Pravilno (alkin formule c3H4)
Pravilnik je drugi najpreprostejši alkyne, ki obstaja. Ta spojina je sestavljena iz tri -ogljikove verige, od katerih sta dve povezani s trojno kovalentno povezavo.
Vam lahko služi: nenasičeni ogljikovodiki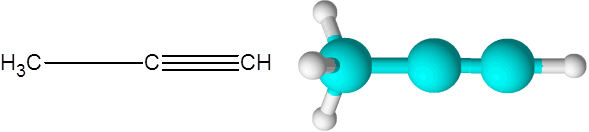 Propino molekula
Propino molekula Tu lahko vidite tudi, da trije ogljikovi in zadnji vodikov atom (tisti na desni) tvorijo ravno črto. V modelu je tudi mogoče videti, da je preprosta povezava C-C daljša od povezave Triple C-C.
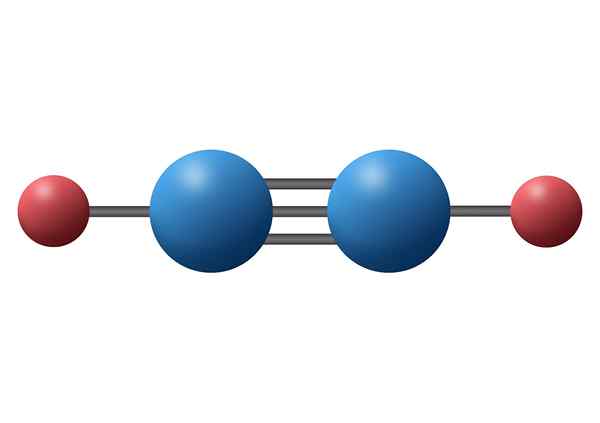
Ogljikov monoksid (CO)
Ogljikov monoksid je strupeni anorganski plin, ki ima negativen atom ogljika in pozitiven kisik, povezan s trojno kovalentno vezjo. V tem primeru je polarna vez zaradi razlike v elektronegativnosti med ogljikom in kisikom.
 Molekula ogljikovega monoksida
Molekula ogljikovega monoksida

