Značilnosti in primeri polarne kovalentne povezave
- 1795
- 503
- Dexter Koch
A Polarna kovalentna vez To je oblikovano med dvema kemičnimi elementi, katerih razlika v elektronegativnosti je velika, vendar ne da bi se približali čisto ionskemu značaju. To je torej vmesna močna interakcija med apolarnimi kovalentnimi vezmi in ionskimi povezavami.
Govori se, da je kovalentna, ker je teoretično med obema povezanimi atomi pravična delitev elektronskega para; to pomeni, da sta oba elektrona enakovredno deljena. Atom E · podari elektron, · x pa drugi elektron, ki tvori kovalentno vez e: x ali e-x.
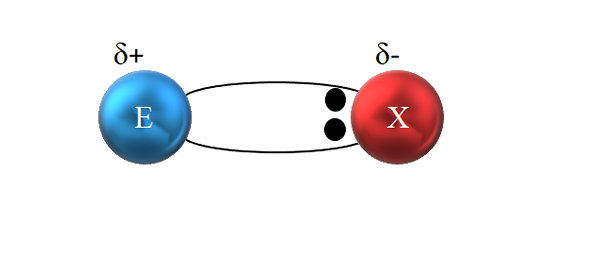
 V polarni kovalentni vezi se par elektronov ne deli pravično. Vir: Gabriel Bolívar.
V polarni kovalentni vezi se par elektronov ne deli pravično. Vir: Gabriel Bolívar. Vendar, kot je razvidno iz zgornje slike, oba elektrona nista nameščena v središču E in X, kar kaže, da "krožijo" z enako frekvenco med obema atomama; vendar so bližje x kot E. To pomeni, da je X pritegnil par elektronov zase zaradi svoje večje elektronegativnosti.
Ker je elektroni povezave bližje x kot E, se ustvari območje visoke elektronske gostote, δ-; Medtem ko se v E Slaba regija pojavlja v elektroni, δ+. Zato obstaja polarizacija električnih nabojev: polarna kovalentna vez.
[TOC]
Značilnosti
Stopnje polarnosti
Kovalentne vezi so zelo obilne narave. So praktično prisotni v vseh heterogenih molekulah in kemičnih spojinah; Ker se navsezadnje tvori, ko sta povezana dva različna atoma E in X. Vendar je več polarnih kovalentnih vezi kot druge, in če želite ugotoviti, se morate zateči k elektronegativnostim.
Koliko več elektronegativa je x in manj elektronegative e e (elektropozitivno), potem bo nastala kovalentna vez bolj polarna. Običajni način za oceno te polarnosti je skozi formulo:
Vam lahko služi: natrijev borohidrid (NABH4): struktura, lastnosti, uporabeχX - χIn
Kjer je χ elektronegativnost vsakega atoma v skladu s Pauling lestvico.
Če ima to odštevanje ali odštevanje vrednosti med 0,5 in 2, potem bo to polarna povezava. Zato je mogoče primerjati stopnjo polarnosti med več povezavami E-X. V primeru, da je pridobljena vrednost višja od 2, se govori o ionski povezavi in+X- In niδ+-Xδ-.
Vendar polarnost povezave E-X ni absolutna, ampak je odvisna od molekularnega okolja; Torej v molekuli -e-x-, kjer E in x tvorita kovalentne vezi z drugimi atomi, slednja neposredno vpliva na to stopnjo polarnosti.
Kemični elementi, ki jih izvirajo
Medtem ko sta E in X lahko kateri koli element, ne izvirata polarnih kovalentnih vezi. Na primer, če je E zelo elektropozitivna kovina, kot so alkalin (Li, NA, K, RB in CS) in X Halogen (F, Cl, Br in I), bodo ponavadi tvorili ionske spojine (NA+Cl-) in ne molekul (NA-CL).
Zato so polarne kovalentne vezi običajno med dvema nemetalnima elementoma; in v manjši meri, med nemetalnimi elementi in nekaterimi prehodnimi kovinami. Videti blok str Iz periodične tabele obstaja veliko možnosti za oblikovanje te vrste kemičnih povezav.
Polarni in ionski značaj
V velikih molekulah ni pomembno razmišljati o tem, kako polarna je povezava; Te so zelo kovalentne, in porazdelitev njihovih električnih nabojev (kjer so bogata ali slaba območja elektronov) je bolj pozorna, da opredelijo stopnjo kovalentnosti njihovih notranjih povezav.
Vam lahko služi: plinska kromatografijaVendar je z diatomičnimi ali majhnimi molekulami povedala polarnost inδ+-Xδ- Je povsem relativno.
To ni problem z molekulami, ki nastanejo med nemetalnimi elementi; Ko pa sodelujejo prehodne ali metaloidne kovine, ni več samo govora o polarni kovalentni vezi, temveč o kovalentni vezi z določenim ionskim značajem; in v primeru prehodnih kovin, kovalentne koordinacijske povezave glede na naravo istega.
Primeri polarne kovalentne vezi
Co
Kovalentna vez med ogljikom in kisikom je polarna, saj je prva manj elektronegativna (χC = 2,55), da je drugi (χTudi = 3,44). Torej, ko vidimo povezave c-o, c = o o c-o-, Vedeli bomo, da gre za polarne povezave.
H-X
Vodikovi halogenidi, HX, so idealni primeri za razumevanje polarne vezi v njihovih diatomskih molekulah. Z vodikovo elektronegativnostjo (χH = 2.2), lahko ocenimo, kako polarni so ti halogenuros:
-Hf (h-f), χF (3,98) - χH (2,2) = 1,78
-Hcl (h-cl), χCl (3,16) - χH (2,2) = 0,96
-HBR (H-BR), χBr (2,96) - χH (2,2) = 0,76
-Živjo (h-i), χYo (2,66) - χH (2,2) = 0,46
Upoštevajte, da je po teh izračunih povezava H-F najbolj polarna od vseh. Zdaj, kakšen je njen ionski značaj, izražen kot odstotek, je druga tema. Ta rezultat ni presenetljiv, ker je fluor najbolj elektronegativni element vseh.
Ko se elektronegativnost spusti iz klora do joda, povezave H-CL, H-BR in H-I postanejo manj polarne. Povezava H-I bi morala biti apolarna, v resnici pa je polarna in tudi zelo "krhka"; zlahka prekine.
Vam lahko služi: živosrebrni hidroksid: struktura, lastnosti, uporabe, tveganjaO-h
Polarna povezava O-H je morda najpomembnejša od vseh: zahvaljujoč njemu je življenje, saj sodeluje z dipolskim trenutkom vode. Če ocenimo razliko med elektronegativnosti kisika in vodičev, bomo imeli:
χTudi (3,44) - χH (2,2) = 1,24
Vendar pa molekula vode, h2Ali ima dve od teh povezav, H-O-H. Ta in kotna geometrija molekule in njene asimetrije je zelo polarna spojina.
N-h
Povezava N-H je prisotna v amino skupinah beljakovin. Ponavljanje istega izračuna imamo:
χN (3.04) - χH (2,2) = 0,84
To odraža, da je N-H povezava manj polarna od O-H (1,24) in F-H (1,78).
Grdo
Povezava Fe-O je pomembna, ker njihovi oksidi najdemo v železnih mineralih. Poglejmo, ali je bolj polarno kot H-O:
χTudi (3,44) - χVera (1,83) = 1,61
Od tu se pravilno domneva, da je povezava Fe-O bolj polarna od povezave H-O (1,24); ali kaj je enako kot: Fe-O ima večji ionski značaj kot H-O.
Ti izračuni služijo za prikaz stopnje polarnosti med več povezavami; Vendar niso dovolj, da bi vladali, ali je spojina ionska, kovalentna ali njen ionski značaj.
Reference
- Whitten, Davis, Peck & Stanley. (2008). Kemija. (8. izd.). Cengage učenje.
- Shiver & Atkins. (2008). Anorganska kemija. (Četrta izdaja). MC Graw Hill.
- Laura Nappi. (2019). Polarne in nepolarne kovalentne vezi: definicije in primer. Študij. Okrevano od: študij.com
- Čelada, Anne Marie, ph.D. (18. september 2019). Opredelitev in primer polarne vezi (polarna kovalentna vez). Okreval od: Thoughtco.com
- Elsevier b.V.(2019). Polarna kovalentna vez. Znanstveno. Pridobljeno iz: SCINCEDIRECT.com
- Wikipedija. (2019). Kemična polarnost. Pridobljeno iz: v.Wikipedija.org
- Anonimno. (5. junij 2019). Lastnosti polarnih kovalentnih vezi. Kemija librettexts. Okrevano od: kem.Librettexts.org

