Ne -polarna kovalentna vez
- 4769
- 13
- Percy Feeney
Pojasnjujemo, kaj je ne -polarna kovalentna vez, njegove značilnosti in več primerov
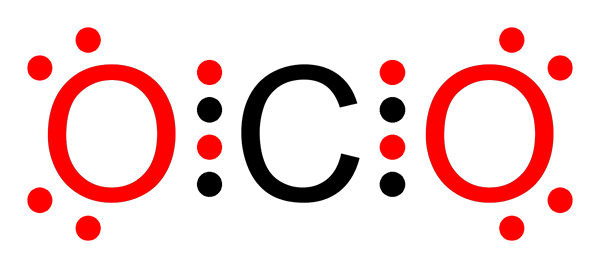
 Ne -polarna kovalentna vez ogljikovega dioksida
Ne -polarna kovalentna vez ogljikovega dioksida Kaj je ne -polarna kovalentna vez?
A ne -polarna kovalentna vez, Imenovana tudi čista ali apolarna kovalentna vez, združitev dveh atomov, ki si enako ali več parov elektronov delita. Z drugimi besedami.
Ta vrsta povezave je med dvema enakima atomama (istega elementa) ali med dvema različnima atomama, vendar imata zelo podobne elektronegativnosti.
Obstajajo tri vrste kemičnih povezav, ki atome ohranjajo skupaj. To so: ionska vez, kovalentna vez in kovinska povezava. Te povezave se razlikujejo glede na to, kako se elektroni porazdelijo okoli atomov.
V primeru kovalentnih vezi si oba atoma delita valenčne elektrone, kar pomeni, da se ti elektroni, namesto da bi se vrteli okoli atoma, vrtijo okoli obeh. Vendar to ni vedno pravično, saj elektroni raje preživijo več časa v bližini najbolj elektronegativnega atoma, kar povzroči polarno kovalentno vez.
V primeru ne -polarnih kovalentnih vezi se to ne zgodi, saj imata oba atoma enako elektronegativnost ali zelo podobne elektronegativnosti.
Značilnosti ne -polarne kovalentne povezave
1. Nastajajo med atomi z enakimi ali zelo podobnimi elektronegativnostmi
So kovalentne povezave, ki se tvorijo med enakimi atomi ali imajo zelo podobne elektronegativnosti. Na splošno se šteje, da kovalentna vez ne polarna, če je razlika v elektronaciji manjša ali enaka 0,4.
Vam lahko služi: sukcinska kislina: struktura, lastnosti, pridobivanje, uporabe2. Lahko so preprosti, dvojni ali potrošniki
Odvisno od števila parov elektronov, ki si jih oba atoma delita, so lahko ne -polarne ali apolarne kovalentne vezi preproste, dvojne ali trojne.
Ko vez tvori en sam par elektronov, se imenuje preprosta povezava, ko se delita dva elektronska para, se imenuje dvojna vez, in če se trije elektronski pari delijo, se imenuje Triple Link.
3. Skoraj vedno vključujejo ne -koščke
Kovine so elementi z zelo nizkimi elektronegativnosti, ki tvorijo kovinske povezave med seboj. Kadar so povezani z ne -komali, vedno tvorijo bodisi ionske vezi bodisi polarne povezave. Zaradi tega se ne -polarne kovalentne vezi tvorijo samo med ne -metalnimi elementi, kot sta vodik in ogljik.
4. Povzročijo apolarne spojine
Spojina, ki ima samo ne -polarne kovalentne vezi, bodo oblikovali apolarne molekule. Za te vrste spojin je značilno, da imajo nizke vrele in fuzijske točke v primerjavi s kovinami in ionskimi spojinami (nekatere so celo plini pri sobni temperaturi), so netopne v vodi in so slabi vodniki toplote in električne energije.
5. Lahko tvorijo trdne, tekoče ali plinaste spojine pri sobni temperaturi
Spojine z ne -polarnimi kovalentnimi vezmi imajo lahko nizke, a zelo raznolike vrele in fuzijske točke.
Zaradi tega so nekateri plini pri sobni temperaturi (kot je vodik, h2, in dušik, n2), druge so tekočine (na primer Bromo, BR2), medtem ko so drugi trdni (na primer naftalen, c10H8).
6. Imajo razmeroma nizke energije povezave.
V primerjavi z ionskimi povezavami je ne -polarne kovalentne vezi lažje prekiniti, saj imajo energijo nižje povezave. To pomeni, da morate porabiti manj energije za prekinitev ne -polarne kovalentne vezi kot ionska vez.
Vam lahko služi: stehiometrični zakoniPrimeri ne -polarnih kovalentnih povezav
H-h povezava v molekuli vodika (H2)
V molekuli vodika, h2, Dva atoma vodika imata svoje edine valenčne elektrone, da tvorita preprosto kovalentno vez.
 Molekula vodika
Molekula vodika Ker sta oba atoma enaka, bo razlika v elektronegativnosti med obema nič, zato je ta povezava ne -polarna kovalentna vez.
F-F povezava v molekuli fluora (F2)
Ta primer poudarja dejstvo, da ni pomembno elektronegativnost atoma, ampak razlika v elektronegativnosti obeh atomov, ki tvorijo povezavo, da vedo, ali bo povezava kovalentna in ne polarna ali ne.
 Molekula fluora
Molekula fluora Fluor je najbolj elektronegativni element periodične tabele, zato se nagiba, da svoje elektrone odstrani iz drugih elementov, da tvori polarne ali ionske vezi.
Ko pa je atom fluorida povezan z drugim, ki mu je enak, ne more odstraniti elektronov iz drugega (v elektronegativnosti ni razlike ne -polarna kovalentna povezava.
O-O povezave v ozonski molekuli (ali3)
Kot v primeru molekule fluora je tudi kisik tudi zelo elektronegativni element. Vendar z oblikovanjem povezav z drugimi atomi kisika tvori ne -polarne kovalentne vezi. Takšen je primer ozonske molekule.
 Ozonska molekula
Ozonska molekula V tem primeru je atom osrednjega kisika povezan z dvema atoma kisika s pomočjo ne -polarnih ali apolarnih kovalentnih vezi.
Vam lahko služi: magnezijev oksid: struktura, lastnosti, nomenklatura, uporabljaN-N povezava v dušikovi molekuli (n2)
Molekula dušika vsebuje ne -polarno kovalentno vez, v kateri vsak dušikov atom deli svoje tri valenčne elektrone z drugim izgine.
 Molekula dušika
Molekula dušika Zaradi tega imata oba atoma skupno tri pare elektronov in tako tvorita trojno kovalentno vez.
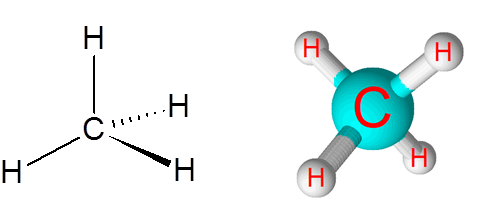
C-H povezave v molekuli metana (CH4)
Metan je primer ne -polarne kovalentne vezi, ki nastane med atomi različnih elementov, v tem primeru ogljik in vodik.
 Molekula metana
Molekula metana Razlika v elektronegativnosti med obema elementoma je 0,4, ki to mejo postavlja tik med ne -polarno in polarno vezjo.
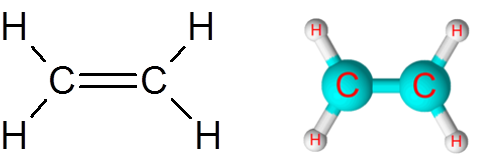
Povezava C = C v molekuli etilen (c2H4)
Etilen molekula, imenovana tudi Eteno, ima skupno pet povezav. Štiri povezave C-H in dvojna vez C = C. V obeh primerih povezave ustrezajo ne -polarnim ali apolarnim kovalentnim vezmi.
 Molekula etilena
Molekula etilena
- « 6 plesov in plesov, značilnih za Quintana Roo, bolj znano
- 9 plesov in tipičnih plesov Michoacána bolj znane »

