Dvojna kovalentna vez

- 4180
- 410
- Miguel Gutmann DVM
Pojasnjujemo, kaj je dvojna kovalentna vez, njegove značilnosti in dajemo več primerov
 Molekula eteno ali etilen. To je tipičen primer dvojne kovalentne vezi med dvema atoma ogljika
Molekula eteno ali etilen. To je tipičen primer dvojne kovalentne vezi med dvema atoma ogljika Kaj je dvojna kovalentna vez?
The dvojne kovalentne vezi Gre za kemične povezave, v katerih imata dva atoma dva para elektronov. Z drugimi besedami, to so kovalentne vezi, ki jih tvorijo skupno štiri valenčne elektrone, ki se vrtijo okoli dveh atomov.
Dvojne povezave so zelo pogoste v organskih spojinah. Na primer, vsi alkeni imajo dvojno ogljično-ogljikovo vez. Številne druge funkcionalne skupine, kot so aldehidi, ketone, karboksilne kisline in amidi, imajo tudi dvojne kovalentne vezi med ogljikom in kisikom. Drugi, na primer imin, imajo dvojne kovalentne vezi c = n.
Dvojne povezave imajo številne značilnosti, ki jih razlikujejo od drugih vrst kovalentnih vezi, kot so preproste povezave in trojne povezave. Se razlikujejo po obliki molekul, ki jih vsebujejo, v dolžini in povezavi ter drugih značilnostih, povezanih z njihovimi kemičnimi lastnostmi.
Značilnosti dvojne kovalentne povezave
Oblikovajo jih 4 elektroni
Razlog, zakaj dvojne vezi so zato, ker vsebujejo dvojne elektrone preproste kovalentne vezi, ki se tvori, ko imata dva atoma dva valenčna elektrona. To pomeni, da vsaka dvojna vez vsebuje 4 elektrone.
Oblikovajo jih s povezavo sigma (σ) in pi (π) povezavo
Od štirih elektronov, ki tvorijo dvojno vez, odhajata in prihajata med enim atomom in drugo, skozi sredino obeh. Ta par elektronov se imenuje Sigma elektroni, saj tvorijo sigma vez (σ).
Drugi par elektronov lebdi nad in pod obema atomama, kar naredi nekakšen sendvič. Ti elektroni se imenujejo Pi elektroni in tvorijo povezavo PI (π).
Vam lahko služi: klorobenzen (C6H5Cl)Skupaj sigma povezava in pi povezava tvorita dvojno kovalentno vez.
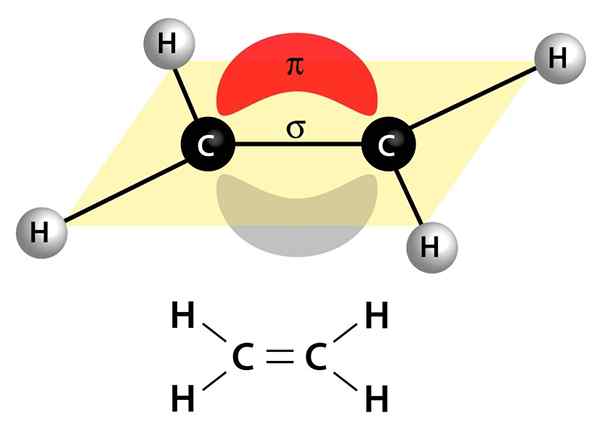 Ta slika prikazuje dve povezavi, ki sestavljata dvojno vez: povezavo PI, ki se pojavlja kot rdeč in siv oblak, ki je zgoraj in pod molekulo, ter povezava Sigma, ki je črta, ki se pridruži obema jedrima skozi sredino
Ta slika prikazuje dve povezavi, ki sestavljata dvojno vez: povezavo PI, ki se pojavlja kot rdeč in siv oblak, ki je zgoraj in pod molekulo, ter povezava Sigma, ki je črta, ki se pridruži obema jedrima skozi sredino Lahko so polarni ali apolarni
Glede na elektronegativnost atomov, ki so združeni z dvojno kovalentno vezjo, je lahko polarna ali apolarna.
Na primer dvojna kovalentna vez C = c To bo apolarna povezava, saj sta oba atoma enaka in imata isto elektronegativnost. Namesto tega dvojna kovalentna vez C = O Bo polarno, saj je kisik veliko bolj elektronegativen kot ogljik.
So močnejši od preprostih povezav
Razbijanje dvojne vezi je težje kot razbijanje preproste povezave med istima dvema atomama. To je zato, ker je treba za razbijanje dvojne vezi tako sigma povezavo (ki je enaka preprosti povezavi) in povezava PI porušiti. Ker je treba namesto ene razbiti dve povezavi, je dvojna vez močnejša od preproste.
So šibkejši od trojnih povezav
V primerjavi s trojno povezavo je dvojna vez šibkejša in lažja za prekinitev. Razlog je enak kot prej, le da ima v tem primeru dvojna vez manj povezave kot lomljenje v primerjavi s trojno povezavo.
So krajše od preprostih povezav
Ker so močnejše povezave kot preproste povezave, lahko dvojne vezi zbližajo povezane atome kot preproste povezave kot preproste povezave. Zaradi tega, če se dvojna povezava C = C primerja s preprosto povezavo C-C, je prva vedno krajša od drugega.
Vam lahko služi: natrijev tiosulfat (NA2S2O3)So daljše od trojnih povezav
Ko je trojna povezava spet močnejša od dvojne povezave, je trojna povezava krajša. To pomeni, da so dvojne kovalentne vezi daljše od trojnih.
So toge povezave.
Preproste kovalentne vezi so precej prilagodljive in se lahko tudi vrtijo. Po drugi strani so dvojne vezi toge, niso prožne in jih ni mogoče zasukati, saj bi bila zgoraj omenjena povezava PI porušena.
Predstavljajo nenasičenost
Molekula, ki ima dvojno vez, bo imela dva manj povezana atoma vodika, kot bi jo lahko. Zaradi tega naj bi dvojna vez predstavljala nenasičenost (vsaka nenasilnost ustreza 2 vodikom).
Tvorijo molekule v obliki ravnega trikotnika
Ogljikov atom, ki tvori dvojno kovalentno vez in dve drugi preprosti vezi, vedno tvori ravno molekulo, v kateri tri vezi kažejo na konce trikotnika. Ta oblika se imenuje ravna trigonalna geometrija.
Primeri dvojnih kovalentnih vezi
Povezava C = C v etilenu
Etilen je eden najpreprostejših primerov dvojne kovalentne vezi, v tem primeru med dvema atoma ogljika.
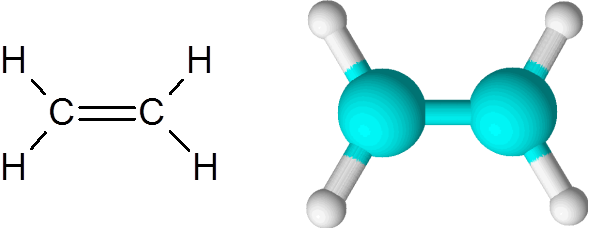 Molekula etilena
Molekula etilena Molekula je popolnoma ravna in povezave ni mogoče zasukati v katero koli smer. Ta dvojna vez je popolnoma apolarna, saj povezuje dva enaka atoma.
Povezava C = O v acetonu
Vsi ketoni vsebujejo karbonilno skupino, ki je sestavljena iz ogljikovega atoma in kisikovega atoma združenega z dvojno kovalentno vezjo.
Vam lahko služi: kaj je kemična kinetika?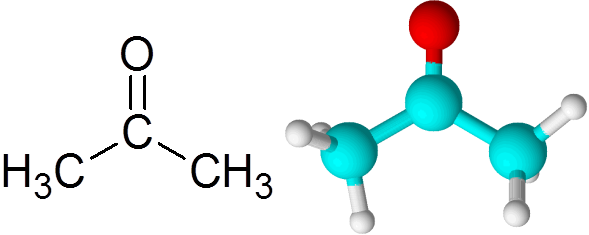 Molekula acetona
Molekula acetona Vsak atom prispeva dva manjkajoča elektrona, da tvorita povezavo PI in Sigma, ki sestavljata dvojno vez. Večina kemičnih reakcij, ki se pojavijo na ketoni, je posledica dvojne vezi c = o.
Povezava o = ali v ozonski molekuli (ali3)
V tem primeru je atom osrednjega kisika povezan z dvema atoma kisika. Ena od obeh obveznic tvori 4 elektroni, zato ustreza dvojni kovalentni vezi. Trije atomi in nekaj elektronov brez skupne rabe, ki imajo osrednji atom kisika, so vsi v isti ravnini zaslona, ki kažejo na vogale trikotnika.
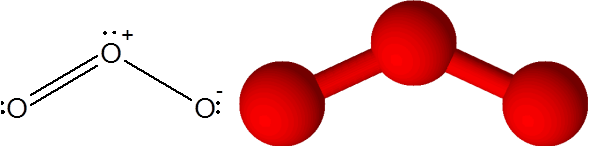 Ozonska molekula
Ozonska molekula Ozon ima posebnost, da lahko dvojna vez "skoči" iz enega od končnih kisika na drugega. Pravzaprav to počne zelo hitro s postopkom, imenovanim resonanca.
C = C povezave v butadieno (c4H6)
Butadieno je primer organske spojine, ki ima dve dvojni kovalentni vezi c = c.
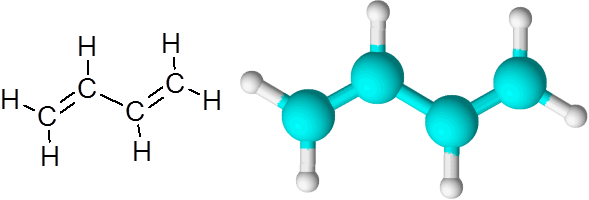 1.3-butadienska molekula
1.3-butadienska molekula Ko so dvojne vezi na ta način, ločene z eno preprosto povezavo, se reče, da so konjugirane dvojne povezave.

