Koordinirana kovalentna vez
- 1060
- 98
- Miguel Gutmann DVM
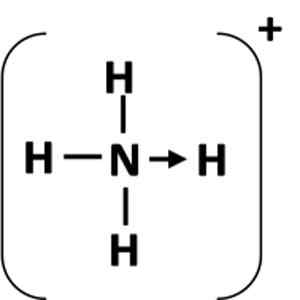
 Slika 1: Predstavitev koordinacijske povezave med atomom dajalca (N) in sprejemnikom (H).
Slika 1: Predstavitev koordinacijske povezave med atomom dajalca (N) in sprejemnikom (H). Kaj je usklajena kovalentna povezava?
A Koordinirana kovalentna vez, ali koordinacijska povezava, jeVrsta povezave, v kateri eden od atomov dobavlja vse skupne elektrone. Imenuje se tudi dativ ali bipolarna povezava.
V preprosti kovalentni povezavi vsak atom dobavi elektron na povezavo. Po drugi strani pa v koordinacijski povezavi en sam atom podari elektrone, da tvori povezavo, in se imenuje atom dajalca, medtem ko atom, ki sprejema par elektronov, ki se pridružijo.
Koordinacijska povezava predstavlja puščica, ki se začne iz atomov dajanja in se konča v atomu akceptorja (slika 1). V nekaterih primerih je darovalec lahko molekula.
V tem primeru lahko atom v molekuli podari par elektronov, kar bi bila osnova Lewisa, medtem ko bi bila molekula z zmogljivostjo Acceptor Lewis kislina.
Koordinacijska povezava ima podobne značilnosti kot preproste kovalentne vezi. Spojine, ki imajo to vrsto povezave, imajo običajno nizko taljenje in vrelišče, z neobstoječo kulombično interakcijo med atomi (za razliko od ionske vezi) in spojinami so zelo topne v vodi.
Nekaj primerov usklajenih kovalentnih povezav
Najpogostejši primer koordinacijske povezave je amonijev ion, ki ga tvori kombinacija molekule amonijaka in protona iz kisline.
Vam lahko služi: kemična enačba: deli in primeriV amoniaku ima dušikov atom samotni par elektronov po dokončanju okteta. Naredil je ta osamljeni par za vodikov ion, tako da dušikov atom postane darovalec. Atom vodika postane sprejemnik.
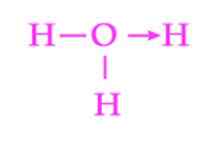 Slika 2: Predstavitev koordinacijske povezave hidronijskega iona
Slika 2: Predstavitev koordinacijske povezave hidronijskega iona Drug pogost primer dativne povezave je tvorba hidronijevega iona. Tako kot pri amonijevem ionu tudi par prostih elektronov molekule vode služi kot dajalec protona, ki je sprejemnik (slika 2).
Vendar je treba upoštevati, da so, ko je vzpostavljena koordinacijska povezava, vsi vodiki, pritrjeni na kisik. Ko se vodikov ion spet zlomi, ni diskriminacije med tem, katero od vodičev se sprosti.
Odličen primer reakcije na osnovi kisline, ki ponazarja tvorbo usklajene kovalentne vezi, je reakcija tvorbe adukta borovega trifluorida z amoniakom.
Boro trifluorid je spojina, ki nima plemenite strukture plina okoli Atoma Boro. Boron ima v svoji valenčni plasti samo 3 pare elektronov, zato naj bi BF3 primanjkovalo elektronov.
Dušikov dušikov navor amoniaka se lahko uporabi za premagovanje tega pomanjkanja, in oblikovana je spojina, ki pomeni koordinacijsko povezavo.
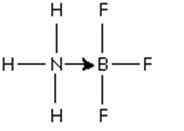 Slika 3: adukt med molekulo bora trifluorida in amonijakom
Slika 3: adukt med molekulo bora trifluorida in amonijakom Ta par dušikovih elektronov je darovan orbitalnemu P praznih boronu. Tu je amonijak osnova Lewisa in BF3 je Lewisova kislina.
Vam lahko služi: dušikove valenceKemija koordinacije
Obstaja veja anorganske kemije, namenjena izključno preučevanju spojin, ki tvorijo prehodne kovine. Te kovine se vežejo na druge atome ali molekule s pomočjo koordinacijskih povezav, da tvorijo zapletene molekule.
Te molekule so znane kot koordinacijske spojine in znanost, ki jih preučuje, se imenuje koordinacijska kemija.
V tem primeru je snov, povezana s kovino, ki bi bila elektronska dajalka, znana kot ligirati in običajno za koordinacijske spojine je znana kot kompleksi.
Koordinacijske spojine vključujejo snovi, kot so vitamin B12, hemoglobin in klorofil, barvila in pigmenti ter katalizatorji, ki se uporabljajo pri pripravi organskih snovi.
Primer zapletenega iona bi bil kobaltni kompleks [CO (NH2Pogl2Pogl2Nh2) 2lnh3]2+ To bi bil dikloroaminethindiamin kobalt (iv).
Kemija koordinacije je nastala iz Alfreda Wernerjevega dela, švicarskega kemika, ki je pregledal različne kobaltove kloridne spojine (III) in amoniak. Po dodatku klorovodikove kisline je Werner opazil, da amoniaka ni mogoče popolnoma odpraviti. Nato je predlagal, da bi moral biti amonijak tesneje povezan z osrednjim kobaltnim ionom.
Ko pa je bil dodan vodni srebrni nitrat, je bil eden od nastalih izdelkov trden srebrni klorid. Količina nastalega srebrnega klorida je bila povezana s številom molekul amoniaka, povezanih s kobaltnim kloridom (III).
Na primer, ko je bil dodan srebrni nitrat COCL3 · 6nh3, Trije kloridi so postali srebrni klorid.
Vendar, ko je bil COCL dodan srebrni nitrat3 · 5nh3, Samo 2 od treh kloridov sta tvorila srebrni klorid. Ko je bil COCL3.4nh3 S srebrnim nitratom je eden od treh kloridov oborjen kot srebrni klorid.
Lahko vam služi: píchric kislina: kaj je, struktura, sinteza, lastnostiNastala opažanja kažejo na nastanek kompleksnih spojin ali usklajevanje. V notranjosti koordinacijske sfere, ki se v nekaterih besedilih imenuje tudi prva sfera, so ligandi neposredno združeni v osrednjo kovino.
V zunanji koordinacijski sferi, ki se včasih imenujejo druga sfera, so drugi ioni pritrjeni na kompleksni ion. Werner je leta 1913 prejel Nobelovo nagrado za svojo teorijo usklajevanja.
Ta teorija usklajevanja povzroči, da imajo prehodne kovine dve vrsti Valencije: prvo Valencijo, ki jo določa oksidacijska številka kovine, druga pa Valencia, imenovana koordinacijska številka.
Številka oksidacije pravi, koliko kovalentnih vezi lahko nastane v kovini (primer, železo (ii) proizvaja grdo), koordinacijska številka4]- in [FECL4]2-).
V primeru kobalta ima koordinacijsko številko 6. Zato je bila v Wernerjevih poskusih dodajanje srebrnega nitrata količina srebrnega klorida, ki je pustil še heksakordinirani kobalt.
Koordinacijske povezave te vrste spojine so značilno, da je obarvana.
Pravzaprav so odgovorni za tipično obarvanost, povezano s kovino (rdeče železo, modri kobalt itd.) in so pomembne za spektrofotometrične vaje absorpcije in atomske emisije.
Reference
- Kemična vezava. Okreval od Britannice.com.
- Koordinirajo kovalentne vezi.F.). Okreval od kemije.Tutorvista.

