Gibbs proste energijske enote, kako se izračuna, rešijo vaje

- 4704
- 461
- Stuart Armstrong
The Gibbs brez energije (Običajno ga imenujemo g) je termodinamični potencial, ki je opredeljen kot razlika v entalpiji H, razen produkta temperature T, z entropijo sistema:
G = h - t s
Gibbs brezplačna energija se meri v Joulesu (po mednarodnem sistemu), v Ergiosu (za sistem lige enot), v kalorijah ali elektronskih voltih (Za elektro volte).
 Slika 1. Diagram, ki prikazuje opredelitev Gibbsove energije in njenega odnosa z drugimi termodinamičnimi potenciali. Vir: jedrska moč.mreža.
Slika 1. Diagram, ki prikazuje opredelitev Gibbsove energije in njenega odnosa z drugimi termodinamičnimi potenciali. Vir: jedrska moč.mreža. V procesih, ki se pojavljajo pri konstantnem tlaku in temperaturi, je variacija Gibbsove proste energije ΔG = ΔH - t ΔS. V takšnih procesih (g) predstavlja energijo, ki je na voljo v sistemu, ki lahko postane delo.
Na primer, v eksotermičnih kemičnih reakcijah se entalpija zmanjša, medtem ko se entropija povečuje. V funkciji Gibbs se ta dva dejavnika preprečita, vendar le, ko Gibbsova energija zmanjša reakcijo spontano.
Torej, če je variacija G negativna, je postopek spontan. Ko funkcija Gibbs doseže svoj minimum, sistem doseže stabilno ravnovesje. Skratka, v postopku, za katerega tlak in temperatura ostaneta konstantna, lahko pritrdimo:
- Če je postopek spontan, potem ΔG < 0
- Ko je sistem v ravnovesju: ΔG = 0
- V ne-spontanem procesu se poveča: ΔG> 0.
[TOC]
Kako se izračuna?
Gibbs prosta energija (g) se izračuna po definiciji, podani na začetku:
G = H - T⋅s
Entalpija H je termodinamični potencial, opredeljen kot:
H = u + p v
- Korak za korakom
Nato bo narejena korak -korak za korak, da bi poznali neodvisne spremenljivke, katerih funkcija je Gibbs Energy:
1- Prvega zakona termodinamike je notranja energija povezana z entropijo sistema in njegovim volumnom V za reverzibilne procese z diferencialnim odnosom:
Lahko vam služi: etidijev bromid: struktura, lastnosti, uporabe, strupenostdu = dq - dw = tds - pdv
Iz te enačbe izhaja, da je notranja energija U funkcija spremenljivk S in V:
U = u (s, v)
2- Začen je iz definicije H in jemanje diferenciala dobimo:
dh = du + d (p v) = du + vdp + pdv
3- Nadomestitev izraza za DU, pridobljeno v (1), morate:
DH = TDS - PDV + VDP + PDV = TDS + VDP
Od tu je sklenjeno, da je entalpija H odvisna od entropije S in tlaka P, to je:
H = h (s, p)
4- Zdaj se izračuna skupna diferencial Gibbs proste energije, ki dobi:
Dg = dh -tds -sdt = tds + vdp -tds -sdt
Kjer je DH nadomeščen z izrazom, ki ga najdemo v (3).
5- Končno s poenostavitvijo dobite: DG = VDP - SDT, Jasno je, da je prosta energija g odvisna od tlaka in temperature t kot:
G = g (p, t)
- Maxwellovi termodinamični odnosi
Iz analize v prejšnjem razdelku izhaja, da je notranja energija sistema funkcija entropije in volumna:
U = u (s, v)
Potem diferencial Ali biti:
du = ∂SU |V DS + ∂VU |S DV = TDS - PDV
Iz tega izraza v delnih derivatih lahko sklepamo tako imenovani Maxwell termodinamični razmerji. Delni derivati veljajo, kadar je funkcija odvisna od več kot ene spremenljivke in jih je enostavno izračunati z uporabo teorema naslednjega razdelka.
Maxwellovo prvo razmerje
∂VT |S = -MonSP |V
Da bi prišli do tega odnosa, Teorem Clairaut - Schwarz o delnih derivatih, ki navajajo naslednje:
"Mešani derivati drugega reda z izmenjanimi spremenljivkami so enaki, pod pogojem, da so funkcije, ki jih je treba izpeljati, neprekinjene in razlike".
Maxwellovo drugo razmerje
Začenši iz tistega, kar je bilo dokazano v točki 3 prejšnjega oddelka:
Vam lahko služi: dejavniki, ki vplivajo na topnostH = H (s, P) in DH = TDS + VDP
Lahko dobimo:
∂StrT |S = ∂SV |Str
Nadaljujte na podoben način z Gibbs Free Energy G = g (p, t) in s prostim energijam Helmholtza F = f (t, v) Pridobiti druga dva termodinamična razmerja Maxwella.
 Slika 2. Josiah Gibbs (1839-1903) je bil ameriški fizik, kemik in matematik, ki je veliko prispeval k termodinamiki. Vir: Wikimedia Commons.
Slika 2. Josiah Gibbs (1839-1903) je bil ameriški fizik, kemik in matematik, ki je veliko prispeval k termodinamiki. Vir: Wikimedia Commons. Maxwellovi štirje termodinamični odnosi
1- povezan z notranjo energijo U: ∂VT |S = -MonSP |V
2- Tisti, pridobljeni iz entalpije H: ∂StrT |S = ∂SV |Str
3- Povezano z energijo Helmholtza F: ∂TP |V = ∂VS |T
4- Povezano s prostim energijam Gibbs G: ∂TV |Str = -MonStrS |T
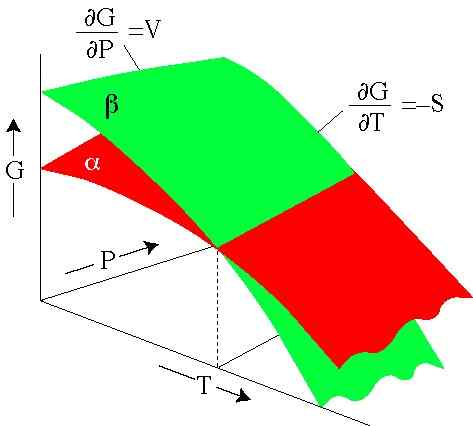 Slika 2. Gibbsova energija je odvisna od tlaka in temperature. Vsaka površina predstavlja fazo. (SERC.Carleton.Edu)
Slika 2. Gibbsova energija je odvisna od tlaka in temperature. Vsaka površina predstavlja fazo. (SERC.Carleton.Edu) Rešene vaje
Vaja 1
Izračunajte variacijo Gibbs proste energije za 2 mola idealnega plina pri temperaturi 300K med izotermalno širitvijo, ki vodi do začetnega volumskega sistema 20 litrov do končne prostornine 40 litrov.
Rešitev
Spominjanje definicije Gibbs Free Energy je:
G = h - t s
Potem bo končna sprememba F:
ΔG = ΔH - t ΔS, Ker ΔT = 0
V idealnih plinih je entalpija odvisna le od njegove absolutne temperature, vendar ker gre za izotermalni postopek, potem ΔH = 0 in ΔG = - t ΔS.
Za idealne pline je entropijska variacija izotermalnega procesa:
ΔS = nr ln (v2/V1)
To velja za primer te vaje:
ΔS = 2 mola x 8,314 j/(k mol) x ln (40L/20L) = 11,53 j/k
Potem lahko dobimo spremembo v Helmholtzovi energiji:
ΔG = - 300K x 11,53 j/k = -3457,70 j.
Vaja 2
Ob upoštevanju, da je Gibbs prosta energija funkcija temperature in tlaka g = g (t, p); Določite variacijo G med postopkom, v katerem se temperatura ne spreminja (izotermalno) za N mole idealnega monoatomskega plina.
Vam lahko služi: stroncijev hidroksid (sr (OH) ₂)Rešitev
Kot je prikazano zgoraj, je sprememba Gibbsove energije odvisna le od spremembe temperature T in volumna V, zato se neskončno majhna variacija izračuna v skladu z:
Dg = -sdt + vdp
Če pa gre za postopek, v katerem je temperatura konstantna, potem df = + VDP, torej končna sprememba tlaka ΔP vodi do spremembe Gibbsove energije, ki jo daje:
ΔG = + ∫ vdp = + ∫ (n r t) dp/p = + n r t ln (Δp)
Z uporabo idealne enačbe plina:
P v = n r t
Med izotermalnim postopkom se zgodi:
D (p v) = p dv + v dp = 0
To je:
dp/p = - dv/v
Torej lahko prejšnji rezultat zapišemo, odvisno od sprememb glasnosti ΔV:
ΔG = + ∫ vdp = + ∫ (n r t) dp/p = - ∫ (n r t) dv/v = -n r t ln (ΔV)
Vaja 3
Glede na naslednjo kemijsko reakcijo:
N20 (g) + (3/2) oz2 (g) ↔️no2 (g) pri temperaturi t = 298 k
Poiščite variacijo Gibbs brez energije in s pridobljenim rezultatom navedite, ali gre za spontani postopek ali ne.
Rešitev
Pod koraki:
- Prvi korak: reakcijske entalpije
ΔHR = 2*ΔH (št2 (g)) - ΔH (n20 (g)) = 2*33.2-81.6 = -15.2kJ/mol
- Drugi korak: Sprememba entropije reakcije
ΔSr = 2*s (ne2 (g)) - s (n20 (g)) - (3/2) s (ali2 (g)) = 2*240.1 - 220.1 - 1,5*205.2 = -47,7 j/(mol*k).
- Tretji korak: Sprememba funkcije Gibbs
Ta vrednost bo določila ravnovesje med zmanjševanjem energije in povečanjem entropije, da vemo, ali je reakcija končno spontana ali ne.
ΔGr = ΔHR -T ΔSR = -15,2 -298*(-47,7) = -985,4 j/mol
Ker gre za negativno variacijo Gibbsove energije, je mogoče sklepati, da gre za spontano reakcijo pri temperaturi 298 K = 25 ° C.
Reference
- Castaños e. Proste energijske vaje. Okrevano od: lidiaconlachimica.WordPress.com.
- Cengel in. 2012. Termodinamika. 7. izdaja. McGraw Hill.
- Librettexts. Gibbs brez energije. Okrevano od: kem.Librettexts.org
- Librettexts. Kaj je brezplačna energija. Okrevano od: kem.Librettexts.org
- Wikipedija. Gibbs brez energije. Okrevano od: je.Wikipedija.com
- Wikipedija. Gibbs brez energije. Pridobljeno iz: v.Wikipedija.com
- « Mohrske metode, reakcije, postopek, uporabe
- Koncept in karakterizacija kristalnih sistemov, tipi, primeri »

