Pojasnilo enačbe Henderson-Haselbalch, primeri, vadba
- 888
- 228
- Raymond Moen
The Enačba Henderson-Haselbalch Gre za matematični izraz, ki omogoča izračun pH amortizerja ali dušenja. Temelji na PKA kisline in razmerja med konjugatom ali koncentracijo soli in kisline, ki je prisotna v raztopini za dušenje.
Enačbo je sprva razvil Lawrence Joseph Henderson (1878-1942) leta 1907. Ta kemik je vzpostavil sestavne dele svoje enačbe, ki temeljijo na ogljikovi kislini kot puferju ali puferski raztopini.
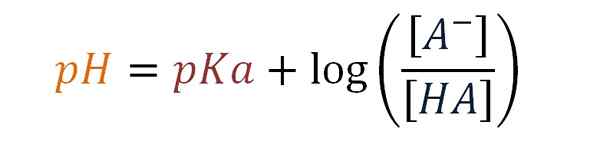 Enačba Henderson-Haselbalch. Vir: Gabriel Bolívar.
Enačba Henderson-Haselbalch. Vir: Gabriel Bolívar. Nato Karl Albert Hasselbalch (1874-1962) leta 1917 uvede uporabo logaritmov za dopolnitev Hendersonove enačbe. Danski kemik je preučeval reakcije krvi s kisikom in vpliv na njegov pH.
Puferska raztopina je sposobna zmanjšati spremembe pH, ki trpijo z raztopino z dodajanjem močne kisline ali osnovnega volumna. Tvori jo šibka kislina in njegova močna konjugirana baza, ki se hitro disociira.
[TOC]
Pojasnilo
Matematični razvoj
Šibka kislina v vodni raztopini se v skladu z naslednjimi shemi loči v skladu z zakonom o množičnem delovanju:
Ha +h2Ali ⇌ h+ + Do-
Ha je šibka kislina in- Tvoja konjugirana baza.
Ta reakcija je reverzibilna in ima ravnotežno konstanto (KA):
Ka = [h+] · [Do-] / [Ha]
Jemanje logaritmov:
dnevnik ka = dnevnik [h+] +Dnevnik [a-] -log [ha]
Če se vsak izraz enačbe pomnoži z (-1), je izražen na naslednji način:
- dnevnik ka = - dnevnik [h+] -log [a] +dnevnik [ha]
The - Log KA je opredeljen kot PKA in - dnevnik [H+] je opredeljen kot ph. Po ustrezni zamenjavi se matematični izraz zmanjša na:
pKA = ph -log [a-] +Dnevnik [ha]
Če očistite izraze pH in prerazporeditev, je enačba izražena na naslednji način:
Vam lahko služi: Triple Covalentna povezavapH = pKA +dnevnik [a-] / [Ha]
To je enačba Henderson-Haselbalch za amortizerja, ki jo tvori šibka kislina.
Enačba za šibko osnovo
Podobno lahko šibka osnova tvori pufersko raztopino in enačba Henderson-Haselbalch zanjo je naslednja:
POH = pkb +log [hb] / [b-]
Vendar izvira večina rešitev za dušenje, vključno s fiziološkimi pomenskimi, iz disociacije šibke kisline. Zato je najbolj uporabljen izraz za enačbo Henderson-Haselbalch:
pH = pKA +dnevnik [a-] / [Ha]
Kako deluje varovalna rešitev?
Ukvarjanje amortizerja
Enačba Henderson-Haselbalch kaže, da je to raztopino tvori šibka kislina in močna konjugirana baza, izražena kot sol. Ta sestava omogoča, da raztopina dušenja ostane s stabilnim pH, čeprav se dodajo močne kisline ali baze.
Z dodajanjem močne kisline v absorber za udarce reagira s konjugirano bazo, da tvori sol in vodo. To nevtralizira kislino in omogoča, da je variacija pH minimalna.
Zdaj, če v amortizer dodamo močno osnovo, reagira s šibko kislino in vodo ter soljo, nevtralizira delovanje dodane podlage na pH. Zato je variacija pH minimalna.
PH raztopine pufra je odvisen od razmerja konjugacijskih koncentracij in šibke kisline in ne od absolutne vrednosti koncentracij teh komponent. Raztopino dušenja z vodo lahko razredčimo in pH se praktično ne bo razlikoval.
Zmogljivost amortizerja
Zmogljivost dušenja je odvisna tudi od PKA šibke kisline, pa tudi od koncentracij šibke kisline in konjugatne baze. Čim bližje kislini PKA je pH raztopine za dušenje, večja je njegova blaznost dušenja.
Vam lahko služi: načelo Le ChâtelierTudi večja kot je koncentracija sestavnih delov puferne raztopine, večja bo njegova zmogljivost dušenja.
Primeri Henderson enačbe
Pufer acetata
pH = pKA +dnevnik [cho3COO-] / [Cho3COOH]
PKA = 4,75
Amortid ogljikove kisline
pH = pKA +dnevnik [HCO3-] / [H2Co3]
PKA = 6.11
Vendar je globalni proces, ki vodi do oblikovanja bikarbonatnega iona v živem organizmu, naslednji:
Co2 + H2Ali ⇌ hco3- + H+
Biti co2 Plin, koncentracija v raztopini se izraža glede na njegov delni tlak.
pH = pKA +dnevnik [HCO3-] / α · pco2
α = 0,03 (mmol/L)/mmHg
Pco2 je delni tlak co2
In potem bi bila enačba kot:
pH = pKA +dnevnik [HCO3-] / 0,03 · PCO2
Laktatni amortiber
pH = pKA +log [laktatni ion] / [laktična kislina]
PKA = 3,86
Fosfatni amortiber
pH = pKA +log [dibasični fosfat] / [monobazični fosfat]]
pH = pKA +dnevnik [HPO42-] / [H2Po4-]
PKA = 6,8
Oksihemoglobin
pH = pKA +dnevnik [HBO2-] / [HHBO2]
PKA = 6,62
Desoxyhemoglobin
pH = pKA +dnevnik [hb-] / Hbh
PKA = 8.18
Rešene vaje
Vaja 1
Absorber fosfatnega udarca je pomemben pri regulaciji telesnega pH, saj je njegov PKA (6,8) blizu pH v telesu (7,4). Kakšna bo vrednost razmerja [NA2HPO42-] / [Nah2Po4-] Henderson-Haselbalch enačbe za vrednost pH = 7,35 in PKA = 6,8?
Nah -jeva disociacijska reakcija2Po4- je:
Ne2Po4- (kislina) ⇌ Nahpo42- (Osnova) +h+
pH = pKA +log [na2HPO42-] / [Nah2Po4-]
Če očistimo [konjugirano / kislinsko] razmerje za raztopino za dušenje fosfata, imamo:
7.35 - 6,8 = log [Na2HPO42-] / [Nah2Po4-]
0,535 = log [na2HPO42-] / [Nah2Po4-]
100,535 = 10dnevnik [na2HPO4] / [nah2po4]
Lahko vam postreže: difenilamin3.43 = [Na2HPO42-] / [Nah2Po4-]
Vaja 2
Raztopina acetatnega pufra ima 0,0135 M koncentracije ocetne kisline in 0,0260 M natrijevega acetata. Izračunajte pH raztopine amortizerja za udarce, saj veste, da je PKA za amortiber acetat 4,75.
Disociacijsko ravnovesje za ocetno kislino je:
Pogl3COOH ⇌ CH3COO- + H+
pH = pKA +dnevnik [cho3COO-] / [Cho3COOH]
Nadomeščanje vrednosti, ki jih imamo:
[Pogl3COO-] / [Cho3COOH] = 0,0260 m / 0,0135 m
[Pogl3COO-] / [Cho3Cooh] = 1,884
dnevnik 1.884 = 0,275
pH = 4,75 +0.275
pH = 5.025
Vaja 3
Absorber za acetat vsebuje 0,1 m ocetne kisline in 0,1 M natrijevega acetata. Izračunajte pH raztopine za dušenje po dodajanju 5 ml 0,05 m pri 10 ml klorovodikove kisline.
Prvi korak je izračun končne koncentracije HCL pri mešanju z pufersko raztopino:
Vi · ci = vf · cf
Cf = vi · (ci / vf)
= 5 ml · (0,05 m / 15 ml)
= 0,017 m
Klorovodikova kislina reagira z natrijevim acetatom, da tvori ocetno kislino. Zato se koncentracija natrijevega acetata zmanjša za 0,017 m, koncentracija ocetne kisline pa se poveča za isto količino:
pH = pKA +dnevnik (0,1 m - 0,017 m) /(0,1 m +0,017 m)
pH = pKA +log 0,083 / 0,017
= 4,75 -0,149
= 4.601
Reference
- Whitten, Davis, Peck & Stanley. (2008). Kemija. (8. izd.). Cengage učenje.
- Jimenez Vargas in J. Mª Macarulla. (1984). Fiziološki fizikalno -kemijski. 6. izdaja. Interameriški uvodnik.
- Wikipedija. (2020). Henderson-Hasselbalch enačba. Pridobljeno iz: v.Wikipedija.org
- Gurinder Khaira in Alexander kot. (5. junij 2019). Henderson-Hasselbalch približek. Kemija librettexts. Okrevano od: kem.Librettexts.org
- Čelada, Anne Marie, ph.D. (29. januarja 2020). Opredelitev enačbe Henderson Hasselbalch. Okreval od: Thoughtco.com
- Uredniki Enyclopeedia Britannica. (6. februar 2020). Lawrence Joseph Henderson. Encyclopædia Britannica. Okrevano od: Britannica.com

