Difenilamin
- 1505
- 326
- Ms. Pablo Lebsack
Kaj je defilamina?
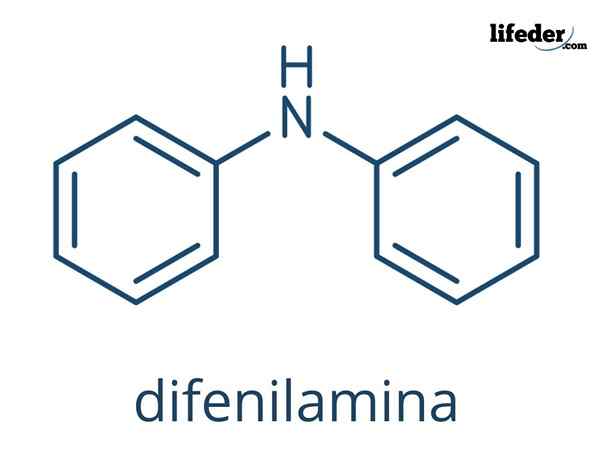
The Difenilamin Gre za organsko spojino, katere kemijska formula je (c6H5)2Nh. Njegovo ime označuje, da je amin, pa tudi njegova formula (-NH2). Po drugi strani se izraz "diffinil" nanaša na prisotnost dveh aromatičnih obročev, povezanih z dušikom. Posledično je defilamin aromatičen amin.
V svetu organskih spojin aromatična beseda ni nujno povezana z obstojem njegovih vonja.

V primeru difenilamina njegova aromatičnost in dejstvo, da njihova trdna snov predstavlja značilno aromo. Vendar pa lahko temelj ali mehanizme, ki urejajo njene kemijske reakcije.
Njegova kemijska struktura, bazičnost, aromatičnost in medmolekulske interakcije so spremenljivke, odgovorne za njegove lastnosti: od barve kristalov do njegove uporabnosti kot antioksidacijskega sredstva.
Kemična struktura defilamina

Na vrhunskih slikah so predstavljene kemične strukture difnilamina. Črne kroglice ustrezajo ogljikovim atomom, beli do vodikovih atomov in modro do dušikovega atoma.
Razlika med obema slikama je model, kako grafično predstavljata molekulo. V spodnjem delu poudarja aromatičnost obročev z črtami, ki so v črni barvi, in tudi ravno geometrijo teh obročev.
Nobena od obeh slik ne prikazuje samotnega para elektronov, ki se ne delijo na dušikovem atomu. Ti elektroni "hodijo" skozi konjugirani π sistem dvojnih vezi v obročih. Ta sistem tvori nekakšen krožni oblak, ki omogoča medmolekularne interakcije; to je z drugimi obroči iz druge molekule.
Lahko vam služi: laboratorijski termometer: značilnosti, za kaj je, uporaba, primeriZgornje pomeni, da ne -Shared dušikov navor hodi po obeh obročih, v tej elektronski gostoti distribuira in se nato vrnejo v dušik, da ponovijo cikel znova.
V tem procesu se razpoložljivost teh elektronov zmanjša, kar ima za posledico zmanjšanje bazičnosti dipelamina (njegova težnja po doniranju elektronov kot lewis baze).
Uporaba/aplikacije dipenilamina
Difenilamin je oksidacijsko sredstvo, ki lahko izpolni vrsto funkcij, med njimi pa so naslednje:
- Med skladiščenjem doživljajo jabolka in hruške fiziološki proces, imenovan skaliranje, povezan s proizvodnjo konjugiranih trienosov, kar vodi do poškodb kože sadja. Ditenilamin delovanje omogoča povečanje obdobja skladiščenja, s čimer zmanjša škodo na 10 % tistega, kar opazimo v njihovi odsotnosti.
- Pri boju z oksidacijo difenilamin in njeni derivati razširijo delovanje motorjev z izogibanjem zgoščevanju rabljenega olja.
- Difenilamin se uporablja za omejitev delovanja ozona pri proizvodnji gume.
- Difenilamin se uporablja v analitični kemiji za odkrivanje nitratov (št3-), Klorati (clo3-) in druga oksidacijska sredstva.
- Gre za indikator, ki se uporablja pri testih odkrivanja zastrupitve z nitrati.
- Ko se RNA hidrolizira eno uro, reagira z defilaminom; To omogoča njegovo količinsko določitev.
- V veterinarski medicini se pri preprečevanju in zdravljenju manifestacij boreridnega črva pri plemenskih živalih uporablja lokalno uporabljen dipe -pilamin.
- Nekateri duelaminski derivati spadajo v kategorijo nesteroidnih protivnetnih zdravil. Imajo lahko tudi farmakološke in terapevtske učinke, kot so antimikrobni, analgetiki, antikonvulzivi in aktivnost proti raku.
Priprava ditenilamina
Seveda se defilamin proizvaja v čebuli, v cilantroh, v listih zelenega in črnega čaja ter v lupinah citrusov. Sintetično obstaja veliko poti, ki vodijo do te spojine, kot je:
Toplotna deaminacija anilina
Pripravimo ga s toplotno deaminacijo anilina (c6H5Nh2) V prisotnosti oksidacijskih katalizatorjev.
Če anilin v tej reakciji ne vključuje atoma kisika v svojo strukturo, zakaj oksidirate? Ker je aromatični obroč skupina za privlačnost elektronov, za razliko od atoma H, ki v molekuli podari svojo nizko elektronsko gostoto dušika.
2 c6H5Nh2 => (C5H5)2 NH+NH3
Tudi anilin lahko reagira z anilinsko kloridno soljo (c6H5Nh3+Cl-) pod ogrevanjem 230 ° C dvajset ur.
C6H5Nh2 + C6H5Nh3+Cl- => (C5H5)2 Nh
Fenotiazinska reakcija
Ditenilamin izvira več, pridobljenih v kombinaciji z različnimi reagenti. Eden od teh je fenotiazin, ki je sintetiziranje z žveplom predhodnik derivatov s farmacevtskim delovanjem.
(C6H5)2NH +2s => s (c6H4) NH +H2S

Lastnosti ditenilamina
Dipenilamin je bela kristalna trdna snov, ki lahko, odvisno od svojih nečistoč, pridobi bronchneal, jantar ali rumene tone. Ima prijetno aromo cvetja, ima molekulsko maso 169,23 g/mol in gostoto 1,2 g/ml.
Molekule teh trdnih snovi medsebojno vplivajo na sile van der Waalsa, med katerimi so vodikovi mostovi, ki jih tvorijo dušikovi atomi (NH-NH) in zlaganje aromatičnih obročev, ki počivajo njihove "elektronske oblake" na drugem.
Vam lahko služi: cinkov sulfid (ZN)Ker aromatični obroči veliko zasedajo. Zgornje povzroči, da trdna snov nima zelo visoke fuzijske točke (53 ° C).
Vendar so v tekočem stanju molekule bolj ločene in učinkovitost vodikovih mostov izboljša. Prav tako je defilamin razmeroma težak, saj potrebuje veliko toplote, da se premakne na plinsko fazo (302 ° C, njegova vrelišče). To je tudi delno posledica teže in interakcij aromatičnih obročev.
Topnost in bazičnost
V vodi je zelo netopen (0,03 g/100 g vode) zaradi hidrofobnega značaja njegovih aromatičnih obročev. Namesto tega je zelo topen v organskih topilih, kot so benzen, ogljikov tetraklorid (CCL4), aceton, etanol, piridin, ocetna kislina itd.
Njegova konstanta kislosti (PKA) je 0,79, kar se nanaša na kislost njegove konjugirane kisline (c6H5Nh3+). Proton, dodan v dušik, ima nagnjenost k deli, ker lahko par elektronov, s katerimi je povezan, hodi skozi aromatične obroče. Tako visoka nestabilnost c6H5Nh3+ Odraža nizko bazičnost difnilamina.
Reference
- Korporacija Lubrizol. (2018). Difenilaminski antioksidanti. Okreval iz Lubrizola.com
- Arun Kumar Mishra, Arvind Kumar. (2017). Farmakološka uporaba difenilamina in njenega derivata kot močna bioaktivna spojina: pregled. Trenutne bioaktivne spojine, letnik 13.
- Prepchem. (2015–2016). Priprava difenilamina. Okreval od Prepchema.com
- Pubchem. (2018). Difenilamin. Okrevano od PubChema.NCBI.NLM.ameriški nacionalni inštitut za zdravje.Gov.
- Wikipedija. (2018). Difenilamin. Pridobljeno iz.Wikipedija.org

