Stroncijev klorid (SRCL2)
- 1239
- 377
- Don Nitzsche
Kaj je stroncijev klorid?
On Stroncijev klorid Gre. Becamgbara) in klor halogen. Ker imata oba elementa zelo različne elektronegativnosti, je spojina ionska snov, katere kemična formula je srcl2.
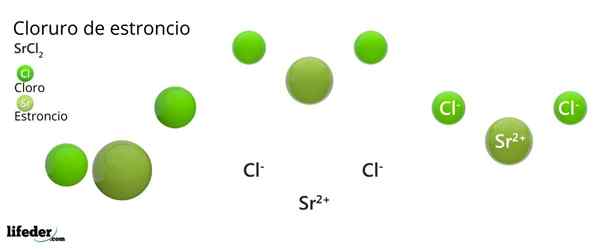
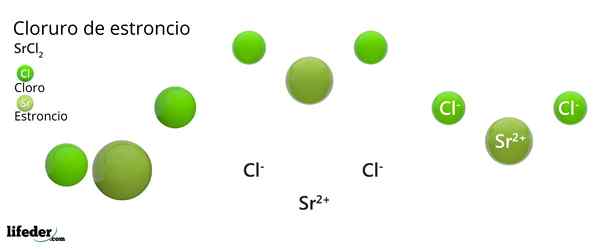
Kot je ionska snov, je sestavljena iz ionov. V primeru SRCL2, So kation SR2+ Za vsaka dva aniona CL-. Njegove lastnosti in aplikacije so podobne kalcija in barijev klorid.
Kot kalcijev klorid (cacl2), je higroskopska in njeni kristali absorbirajo vodo, da tvorijo heksahidratno sol, v kateri je v kristalni rešetki prisotnih šest molekul vode (srcl2· 6H2Da). Pravzaprav je razpoložljivost hidrata večja od SRCL2 brezvodna (brez vode).
Ena od njegovih glavnih aplikacij je kot predhodnik drugih stroncijskih spojin; to pomeni, da predstavlja vir stroncija v določeni kemični sintezi.
Kemična struktura stroncijevega klorida
 Kristalna struktura stroncijevega klorida
Kristalna struktura stroncijevega klorida Vrhunska slika predstavlja kristalno strukturo, ki je deformirana s SRCL2 brezvodna. V tem majhne zelene sfere ustrezajo SR ionom2+, Medtem ko voluminozne zelene sfere predstavljajo ione CL-.
V tej strukturi je vsak SR ion2+ Ga je "zaprto" z osmimi ioni-, Posledično ima koordinacijsko številko, ki je enaka 8 in po možnosti kubična geometrija okoli nje. To pomeni, da štiri zelene sfere naredijo streho kocke, ostale štiri pa v tleh, ki se nahajajo na SR2+ V središču.
Kakšna bi bila fazna struktura sode? Lewisova struktura za to sol je Cl-Sr-Cl, očitno linearna in ob predpostavki, da je sto odstotkov svojih povezav. Vendar v plinski fazi -srcl2(g)- ta "črta" kaže kot približno 130 °, ki je dejansko nekakšen V.
Vam lahko služi: plinasta država: značilnosti, splošni zakon, primeriTega anomalije ni bilo mogoče uspešno razložiti, če upoštevamo dejstvo, da stroncij ni delil elektronov, ki bi zasedli elektronski volumen. Morda ga lahko povzroči udeležba orbitala D v povezavah ali zaradi motenj jedra-elektrona.
Uporaba/uporabe stroncijskega klorida
Srcl2· 6H2Ali pa se uporablja kot dodatek v organskih polimerih; Na primer v polivinilnem alkoholu, da bi spremenili njegove mehanske in električne lastnosti.
Uporablja se kot stroncijev ferit pri izdelavi keramičnih in steklenih magnetov, namenjenih za izdelavo televizijskega sprednjega kristala.
Reagira z natrijevim kromatom (NA2Cro4) za proizvodnjo stroncijskega kromata (srcro4), ki se za aluminij uporablja kot korozijska barva.
Ko se ogrejejo z ognjem, stroncijske spojine zasijejo z rdečkastim plamenom, zato so namenjeni izdelavi ran in ognjemetov.
Zdravilne aplikacije
Radioizotop stroncijevega klorida 89 (najpogostejši izotop je 85Gospod.
Uporaba razredčenih raztopin (3-5 %) več kot dva tedna pri zdravljenju alergijskega rinitisa (kronično vnetje nosne sluznice) kaže na izboljšanje zmanjševanja kihanja in nosnega drgnjenja.
Ko so ga uporabili v formulacijah dentinske paste za zmanjšanje občutljivosti za zob, tvori oviro na mikrotubulah dentinal.
Študije te spojine kažejo na terapevtsko učinkovitost v primerjavi s prednizolonom (presnovek zdravila prednizona) pri zdravljenju ulceroznega kolitisa.
Lahko vam služi: molarna frakcija: kako je izračunana, primeri, vajeNjeni rezultati temeljijo na modelu podgan; Kljub temu predstavlja upanje za tiste bolnike, ki trpijo tudi zaradi osteoporoze, saj lahko gredo v isto zdravilo za boj proti obema boleznima.
Uporablja se za sintezo stroncijskega sulfata (SRSO4), še bolj gostejše kot SRCL2. Vendar njegova minimalna topnost vode ne omogoča dovolj svetlobe, da bi jo lahko uporabili v radiologiji, za razliko od barijevega sulfata (Baso4).
Priprava stroncijskega klorida
Stroncijev klorid lahko pripravimo z neposrednim delovanjem klorovodikove kisline (HCl) na čisti kovini, s čimer se pojavi reakcija redoks tipa:
MR (S) + HCl (AC) => SRCL2(Ac) + h2(g)
Tu se stroncijska kovina oksidira z darovanjem dveh elektronov, ki omogočajo nastanek plinastega vodika.
Tudi hidroksid in stroncijev karbonat (SR (OH)2 in srco3) reagirati s to kislino tako, da jo sintetizira:
Sr (oh)2(s) + 2HCl (AC) => srcl2(AC) + 2H2Ali (l)
Srco3(s) + 2HCl (AC) => srcl2(ac) + co2(g) + h2Ali (l)
Z uporabo tehnik kristalizacije dobimo SRCL2· 6H2Tudi. Po dehidriranem s toplotnim delovanjem, dokler SRCL končno ne nastane2 brezvodna.
Lastnosti stroncijevega klorida
Fizikalne in kemijske lastnosti te spojine so odvisne od tega, ali je v svoji hidrirani ali brezvodni obliki. To je zato, ker se elektrostatične interakcije spreminjajo, ko se molekule vode dodajo kristalni rešetki SRCL2.
Brezvodna
Stroncijev klorid je bela kristalna trdna snov z molekulsko maso 158,53 g/mol in gostoto 3,05 g/ml.
Njegova tališča (874 ° C) in vrenje (1250 ° C) sta visoka, kar kaže na močne elektrostatične interakcije med ioni SR2+ in Cl-. Prav tako odraža veliko kristalno retikularno energijo, ki jo ima njegova brezvodna struktura.
Vam lahko služi: celuloza acetatEntalpija tvorbe srcl2 Trdna je 828,85 kJ/mol. To se nanaša na toplotno energijo, ki jo sprosti vsak mol, ki je nastala iz njegovih komponent v svojih standardnih stanjih: klor in trden plin za stroncija.
Heksahidrat
V obliki heksahidrata ima večjo molekulsko maso kot brezvodna (267 g/mol) obliko in nižjo gostoto (1,96 g/ml). To zmanjšanje njegove gostote je posledica dejstva, da molekule vode "razširijo" kristale in povečajo volumen; Zato se gostota strukture zmanjšuje.
Je skoraj dvakrat gosta kot voda pri sobni temperaturi. Njegova topnost vode je zelo visoka, v etanolu. To je posledica njegovega organskega značaja kljub polarnosti. To pomeni, da je heksahidrat anorganska polarna spojina. Končno pri 150 ° C postane dehidrirano, da nastane brezvodna sol:
Srcl2· 6H2Ali (s) => srcl2(s) + 6h2O (g)
Reference
- Wikipedija. (2018). Stroncijev klorid. Pridobljeno iz.Wikipedija.org
- Droge. (2018). Stroncijev klorid SR-89. Obramnine so se okrevale.AC
- Pubchem. (2018). Stroncijev klorid. Okrevano od PubChema.NCBI.NLM.ameriški nacionalni inštitut za zdravje.Gov
- Bik. Mater. (2010). Vpliv zrnatega stolcijskega klorida kot aditivov na podstranske električne in mehanske lastnosti za čisti polivinilni alkohol. Sci., Vol. 33, ne. 2, str. 149-155. Indijska akademija znanosti.
- Ccoil. (4. september 2009). STONTIJ-KHLORIDE-DAL-3D-SF. [Slika]. Pridobljeno 13. aprila 2018, od: Commons.Wikimedia.org
- Vse reakcije. SRCL2 - STONTIJSKI KLORID. Okreval od allreactions.com