Halogenirani derivati

- 1905
- 304
- Ricky Dach
Pojasnimo, kaj so halogenirani derivati, njihove lastnosti, uporabe/aplikacije in dajemo več primerov
Kaj so halogenirani derivati?
The Halogenirani derivati Vse so spojine, ki imajo atom halogena; to pomeni, kateri od elementov skupine 17 (f, cl, br, i). Ti elementi se od ostalih razlikujejo, ker so bolj elektronegativni, kar tvorijo raznolikost anorganskih in organskih halogenidov.
Spodnja slika halogenov je prikazana na spodnji sliki. Od zgoraj navzdol: fluorid (f2),, Klor (Cl2), Bromo (Br2) in jod (i2). Vsak od njih ima sposobnost reagiranja z veliko večino elementov, tudi med kongeneri iste skupine (Interhalogeni).

Tako imajo halogenirani derivati formulo MX, če gre za kovinski haluro, RX, če je alkil in ARX, če je aromatičen. Zadnja dva se nahajata v kategoriji Organic Haluros. Stabilnost teh spojin zahteva energijsko "korist" pred prvotno molekulo sode.
Fluorid je praviloma halogenirala bolj stabilna kot jod. Razlog je posledica razlik med njihovimi atomskimi radijskimi sprejemniki (vijolične sfere so bolj zajetne od rumenih).
S povečanjem atomskega polmera je prekrivanje orbitalov med halogenom in drugim atomom revnejše, zato je povezava šibkejša.
Nomenklatura
Način, kako pravilno poimenovati te spojine, je odvisen od tega, ali so anorganske ali organske.
Anorganski
Kovinski halogenidi so sestavljeni iz vezi, ionskega ali kovalentnega, med halogenom X in M kovino (skupine 1 in 2, prehodne kovine, težke kovine itd.).
V teh spojinah imajo vsi halogeni stanje oksidacije -1. Ker? Ker so njene konfiguracije Valencije NS2Np5.
Zato morajo za dokončanje okteta Valencije osvojiti samo en elektron, medtem ko kovine oksidirajo, kar jim daje elektrone, ki jih imajo.
Vam lahko služi: natančno ravnovesje: značilnosti, funkcije, deli, uporabeTako fluorid ostane kot f-, fluorid; Cl-, klorid; Br-, bromid; in i-, Nazadnje. MF bi bil poimenovan: fluorid (kovinsko ime) (n), ki je n metal valencia del le, če ima več kot eno. V primeru skupin skupin 1 in 2 ni treba poimenovati Valencije.
Primeri
- NAF: natrijev fluorid.
- Cacl2: Kalcijev klorid.
- AGBR: Srebrni bromid.
- Zni2: Cink joduro.
- Cucl: bakreni klorid (i).
- Cucl2: bakreni klorid (ii).
- Ticl4: Titanov klorid (iv) ali titano tetraklorid.
Vendar lahko vodik in ne -metalni elementi - tudi isti halogeni - tudi haluros tvorijo tudi haluros. V teh primerih Valencia iz kovine na koncu ni imenovana:
- Pcl5: fosfor pentaklorid.
- Bf3: Boro Trifluoruro.
- Ali3: Aluminij Triyoduro.
- HBR: vodikov bromid.
- Če7: jod heptofluorid.
Organsko
Ne glede na to, ali je RX ali ARX, je halogen kovalentno povezan z ogljikovim atomom. V teh primerih se halogene omenjajo z njihovimi imeni, preostala nomenklatura pa je odvisna od molekularne strukture R ali AR.
Za najpreprostejšo organsko molekulo metan (CHO4), Naslednje derivate dobimo z zamenjavo H s CL:
- Pogl3CL: klorometan.
- Pogl2Cl2: diklorometan.
- Chcl3: Tricilorometan (kloroform).
- CCL4: Tetraklorometan (ogljikov klorid (IV) ali ogljikov tetraklorid).
Tukaj je r sestavljen iz enega samega ogljikovega atoma. Nato se za druge alifatske verige (linearne ali veje) šteje število ogljikov, od katerih je povezano s halogenom:
Pogl3Pogl2Pogl2F: 1-fluorpropano.
Prejšnji primer je bil primarni alkilični halogenid. V primeru, da je veriga razvejana, je izbran najdaljši, ki vsebuje halogen in začne šteti, tako da to pustimo po moči:
Vam lahko služi: kakšne so fizične lastnosti snovi?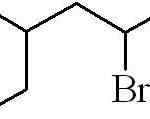
3-metil-5-bromoheksan
Na enak način se zgodi za druge substituente. Tudi za aromatične halogenide je halogen imenovan in nato preostali del strukture:

Vrhunska slika prikazuje spojino, imenovano bromobenzen, ki poudarja atom broma v rjavi barvi.
Lastnosti halogeniranih derivatov
Anorganski halogenidi
Anorganski halogenidi so ionske ali molekularne trdne snovi, čeprav so prvi obilni. Glede na interakcije in ionske radijske sprejemnike MX bo to topno v vodi ali drugih manj polarnih topilih.
Ne -metalni halogenidi (kot je boro) so običajno Lewisove kisline, kar pomeni, da sprejemajo elektrone, da tvorijo komplekse. Po drugi strani pa halogenidi (ali halogenuros) vodika, raztopljenega v vodi.
Njegove talilne točke, vrelišče ali sublimacija padajo na elektrostatične ali kovalentne interakcije med kovino ali ne -kometalom s halogenom.
Prav tako igrajo ionski radijski sprejemniki pomembno vlogo pri teh lastnostih. Na primer, če m+ in x- Imajo podobne velikosti, njihovi kristali bodo bolj stabilni.
Organske halogenide
So polarni. Ker? Ker razlika v elektronegativnosti med C in halogenom ustvarja trajni polarni trenutek v molekuli. Prav tako se to zmanjša, ko se skupina 17 spusti, od povezave C-F do C-I.
Brez upoštevanja molekularne strukture R ali AR, rastoča števila halogena neposredno vplivajo. Večina je nepomembnih z vodo, vendar se lahko raztopijo v organskih topilih.
Uporaba halogeniranih derivatov
Uporaba halogeniranih derivatov bi lahko rezervirala svoje besedilo. Molekularni "spremljevalci" halogenov so ključni dejavnik, glede na to, da njihove lastnosti in reaktivnosti opredeljujejo uporabo derivata.
Vam lahko služi: kalijev sulfat (K2SO4): struktura, lastnosti, uporabe, sintezaTako med veliko raznolikostjo možne uporabe izstopajo naslednje:
- Molekularni halogeni se uporabljajo za ustvarjanje halogenskih žarnic, kjer stopite v stik z žarilnico. Namen te mešanice je reagirati halogen X z izhlapenim volframom. Na ta način se njenemu odlaganju izognemo na površini žarnice, kar zagotavlja več življenjske dobe.
- Fluorurne soli se uporabljajo pri fluorizaciji zobnih voda in paste.
- Natrijev in kalcijev hipokloriti sta dva aktivna sredstva v komercialnih raztopinah za beljenje (klor).
- Čeprav poslabšajo ozonsko plast, se v aerosolih in hladilnih sistemih uporabljajo klorofluoroogljikovodiki (CFC).
- Vinil klorid (CHO2= Chcl) je monomer polivinil polimernega klorida (PVC). Po drugi strani je teflon, ki se uporablja kot material brez palic, sestavljen iz polimernih verig tetrafluoretilena (f2C = cf2).
- Uporabljajo se v analitični kemiji in organski sintezi za različne namene; Med njimi je sinteza zdravil.
Dodatni primeri

Vrhunska slika ponazarja ščitnični hormon, odgovoren za proizvodnjo toplote, pa tudi povečanje splošnega metabolizma v telesu. Ta spojina je primer halogeniranega derivata v človeškem telesu.
Med drugimi halogeniranimi spojinami so omenjene naslednje:
- Diklorodifenilriclorootan (DDT), učinkovit insekticid, vendar z resnimi vplivi na okolje.
- Kositer klorid (snncl2), ki se uporablja kot reducirsko sredstvo.
- Kloroetan ali 1-kloroetan (ch3Pogl2Cl), topični anestetik, ki deluje hitro ohladi kožo.
- Dikloroetilen (CLCH = CCLH) in tetrakloretilen (Cl2C = CCl2), ki se uporablja kot topila v industriji suhega čiščenja.
- « Kemična struktura, lastnosti in uporabe silicijevega karbida
- 80 stavkov za prvo ljubezen, ki nikoli ne pozabi »

