Krivulja ogrevanja Kaj je, kako je, primeri

- 3224
- 922
- Percy Feeney
A Krivulja ogrevanja Gre za grafični prikaz, kako se temperatura vzorca razlikuje kot funkcija časa, ohranja konstanten tlak in enakomerno dodajanje toplote, torej s konstantno hitrostjo.
Za izgradnjo takšnega grafa se vzamejo pari temperaturnih in časovnih vrednosti, ki pozneje grafirajo temperaturo na navpični osi (naročeni) in čas na vodoravni osi (Abscissa).
 Slika 1. Ogrevalna krivulja snovi dobimo z dodajanjem toplote in merjenjem temperature vsakega določenega časovnega intervala. Vir: Pixabay.
Slika 1. Ogrevalna krivulja snovi dobimo z dodajanjem toplote in merjenjem temperature vsakega določenega časovnega intervala. Vir: Pixabay. Nato se prilagodi najprimernejša krivulja teh eksperimentalnih točk in končno dobimo graf temperature T kot funkcija časa T: T (T).
[TOC]
Kakšna je ogrevalna krivulja?
Ko se ogreje, se snov doživlja v zaporednih raznolikih stanjih: trdna se lahko pari, skoraj vedno gre skozi tekoče stanje. Ti procesi se imenujejo spremembe stanja, v katerih vzorec poveča svojo notranjo energijo, hkrati pa dodaja toploto, kot kaže molekularna kinetična teorija.
Z dodajanjem toplote v vzorec obstajata dve možnosti:
- Snov poveča svojo temperaturo, glede na to, da se njeni delci mešajo z večjo intenzivnostjo.
- Material gre skozi fazno spremembo, pri kateri temperatura ostane konstantna. Dodaj toplota ima učinek oslabitve do neke mere sile, ki delce ohranjajo kohezivne, zato je na primer enostavno prehoditi iz ledu v tekočo vodo.
Slika 2 prikazuje štiri stanja snovi: trdna, tekočina, plin in plazma ter imena procesov, ki omogočajo prehod med seboj. Puščice označujejo pomen procesa.
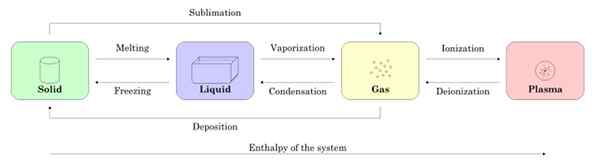 Slika 2. Stanja subjekta in procesov, ki so potrebni za prehod med eno in drugo. Vir: Wikimedia Commons.
Slika 2. Stanja subjekta in procesov, ki so potrebni za prehod med eno in drugo. Vir: Wikimedia Commons. -State spremembe v snovi
Začenši z vzorcem v trdnem stanju, ko taljenje preide v tekoče stanje, ko se uparja, postane plin in z ionizacijo postane plazma.
Lahko vam služi: magnetne lastnosti materialovTrdna snov lahko neposredno postane plin s postopkom, znanim kot sublimacija. Obstajajo snovi, ki zlahka sublim pri sobni temperaturi. Najbolj znan je co2 ali suh led, pa tudi naftalen in jod.
Medtem ko vzorec prestopi spremembo stanja, temperatura ostane konstantna, dokler ne doseže novega stanja. To pomeni, da če je na primer del tekoče vode, ki je dosegla točko vrelišča, njegova temperatura ostane konstantna, dokler vsa voda ne postane para.
Zaradi tega se pričakuje, da bo ogrevalna krivulja sestavljena iz kombinacije rastočih odsekov in vodoravnih odsekov, kjer slednje ustrezajo faznim spremembam. Slika 3 prikazuje eno od teh krivulj za določeno snov.
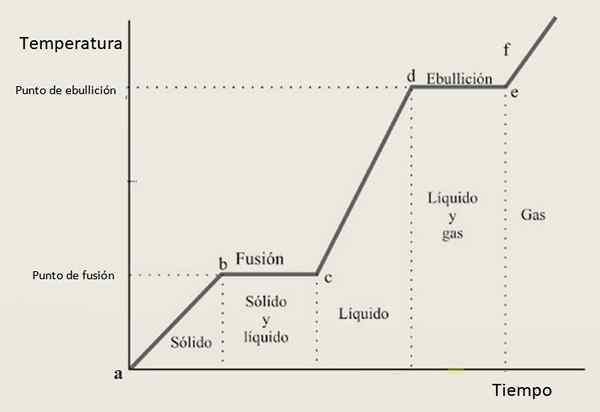 Slika 3. Ogrevalna krivulja dane snovi, s tipično konfiguracijo, ki temelji na korakih in pobočjih.
Slika 3. Ogrevalna krivulja dane snovi, s tipično konfiguracijo, ki temelji na korakih in pobočjih. Interpretacija krivulje ogrevanja
V intervalih rasti Ab, CD in Ef Snov se najde kot trdna, tekoča in plin. V teh regijah se kinetična energija povečuje in s tem temperaturo.
Medtem noter Pr Njegovo stanje od trdne do tekočine se spreminja, zato obe fazi obstajata. Tako je v razdelku od, v katerem vzorec prehaja iz plinske tekočine. Tu se spreminja potencialna energija in temperatura ostane konstantna.
Možen je tudi obratni postopek, to je, da se vzorec lahko ohladi, tako da bo zaporedno sprejel druge države. V tem primeru se govori Hladilna krivulja.
Ogrevalne krivulje imajo enak splošni vidik za vse snovi, čeprav seveda ne enake številčne vrednosti. Nekatere snovi zahtevajo več časa kot druge, da spremenijo stanje in se talijo in izhlapijo pri različnih temperaturah.
Te točke so znane kot tališče in vrelišče in so značilnosti vsake snovi.
Lahko vam služi: Ravna ogledala: enačba, vedenje, grafikaZato so ogrevalne krivulje zelo koristne, saj kažejo numerično vrednost teh temperatur za milijone snovi, ki obstajajo kot trdne snovi in tekočine v območju temperatur, ki veljajo za normalno in pri atmosferskem tlaku.
Kako je narejena ogrevalna krivulja?
Načeloma je zelo preprosto: dovolj je, da vzorec snovi postavimo v posodo, ki je opremljen z mešalnikom, uvedel termometer in enakomerno toploto.
Hkrati se na začetku postopka aktivira štoparica in opazimo ustrezni pari temperature in časa.
Vir toplote je lahko plinski vžigalnik, z dobro ogrevalno hitrostjo ali električno upornost, ki se ob toploti oddaja toplota, ki se lahko poveže s spremenljivim virom, da dobi različne moči.
Za bolj natančnost obstajata dve tehniki, ki se v laboratoriju za kemijo pogosto uporabljata:
- Diferencialna toplotna analiza.
- Diferencialna pometna kalorimetrija.
Primerjajo temperaturno razliko med preučenim vzorcem in drugim referenčnim vzorcem z visoko temperaturo taljenja, skoraj vedno aluminijevega oksida. Te metode želijo enostavno najti fuzijske in vrelišča.
Primeri (voda, železo ...)
Razmislite o ogrevalnih krivuljah za vodo in železo, prikazano na sliki. Časovna lestvica ni prikazana, vendar je takoj.
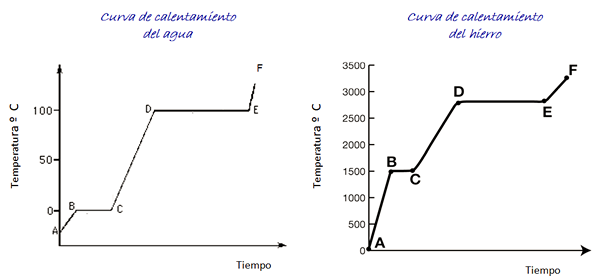 Slika 4. Krivine za ogrevanje vode in železa.
Slika 4. Krivine za ogrevanje vode in železa. Voda je univerzalna snov in temperaturni razpon, potreben za ogled njegovih sprememb v stanju, je enostavno doseči v laboratoriju. Za železo so potrebne veliko višje temperature, vendar kot je navedeno zgoraj, se oblika grafa ne spreminja bistveno.
Vam lahko služi: Steinerjeva teorem: razlaga, aplikacije, vajeTaljenje ledu
Pri segrevanju vzorca ledu, glede na graf smo v točki A pri temperaturi pod 0 ° C. Opazimo, da se temperatura zvišuje s konstantno hitrostjo, dokler ne doseže 0 ° C.
Molekule vode znotraj ledu vibrirajo več širine. Ko dosežemo temperaturo taljenja (točka B), se lahko molekule že premikajo pred drugo.
Energija, ki prispe, je vložena v zmanjšanje sile privlačnosti med molekulami, zato se temperatura med B in C ostane konstantna do vsega ledu.
Pretvorba vode v paro
Ko je voda popolnoma v tekočem stanju, se vibracija molekul spet poveča in temperatura se hitro poveča med C in D do vrelišča za 100 ° C. Med D in E temperatura ostane v tej vrednosti, medtem ko je energija, ki prihaja, odgovorna za izhlapevanje vso vodo v posodi.
Če je vsa vodna paro vsebovana v posodi, jo lahko nadaljujete od točke E do točke F, katere meja ni prikazana v grafiki.
Vzorec železa lahko prečka te iste spremembe. Vendar so glede na naravo materiala temperaturni razponi zelo različni.
Reference
- Atkins, str. Načela kemije: poti odkritja. Pan -american Medical uredništvo. 219-221.
- Chung, str. Ogrevalne krivulje. Okrevano od: kem.Librettexts.org.
- Ogrevalne krivulje. Toplota fuzije in uparjanja. Okrevano od: wikipremed.com.
- Hewitt, Paul. 2012. Konceptualna fizikalna znanost. 5. Ed. Pearson. 174-180.
- Univerza v Valladolidu. Diplomirala iz kemije, obnovljena iz: nastanitev.grozdje.je.
- « Carnotove faze cikla, aplikacije, primeri, vaje
- Zelene značilnosti bromocresola, priprave, uporabe »

