Kakšni so zakoni o teži kemije? (Primeri)

- 3353
- 259
- Don Nitzsche
The Urečniki kemije To so tisti, ki so pokazali, da množice snovi, ki reagirajo, tega ne počnejo samovoljno ali naključno; Toda ohranjanje stalnega matematičnega deleža celih števil ali.
V preteklih časih so za vzpostavitev teh zakonov zahtevala izredna prizadevanja sklepanja; Ker se zdaj zdi preveč očitno, pred atomsko ali molekulsko maso elementov ali spojin sploh niso bili znani.
 Vir: Jeff Keyzer iz Austina, TX, ZDA [CC BY-SA 2.0 (https: // creativeCommons.Org/licence/by-sa/2.0)]
Vir: Jeff Keyzer iz Austina, TX, ZDA [CC BY-SA 2.0 (https: // creativeCommons.Org/licence/by-sa/2.0)] Ker ni bilo znano, kako natančno je bil mol atomov vsakega elementa enakovreden, morajo kemikalije osemnajstega in devetnajstega stoletja temeljiti na reakcijskih masah. Tako da so bile rudimentarne analitične lestvice (vrhunska slika) neločljive spremljevalce med stotimi poskusi, potrebnimi za poravnavo zakonov o tehtanju.
Zaradi tega, ko se te kemije preučijo, so se ob vsakem trenutku naleteli na množične meritve. Zahvaljujoč temu je bilo ekstrapoliranje rezultatov poskusov odkrito, da kemične spojine Čisto Vedno se oblikujejo z enakim masnim deležem svojih sestavnih elementov.
[TOC]
Zakon o ohranjanju mase
Ta zakon pravi, da je v kemični reakciji skupna masa reagentov enaka celotni masi izdelkov; Dokler je obravnavani sistem zaprt in z okolico ni izmenjave mase in energije.
V kemični reakciji snovi ne izginejo, ampak se pretvorijo v druge snovi enake mase; Od tam je znana fraza: "Nič ni ustvarjeno, nič ni uničeno, vse se spremeni".
Zgodovinsko gledano je zakon o ohranjanju množice v kemični reakciji prvič predlagal leta 1756 Mihail Lomonsov, ki je v svojem dnevniku pokazal rezultate svojih poskusov.
Kasneje je leta 1774 Antoine Levoisier, francoski kemik, predstavil rezultate svojih poskusov, ki so lahko to ugotovili; ki ga nekateri imenujejo tudi Lavoisierjev zakon.
-Lavoisier poskusi
V času lavoisierja (1743-1794) je bila teorija o Flogisto. Lavoisierjevi poskusi so lahko to teorijo zavrgli.
Lavoisier je izvedel številne poskuse iz kovinskega izgorevanja. Materiale je skrbno tehtal pred in po zgorevanju v zaprti posodi in ugotovil, da je navidezno povečanje telesne mase.
Toda Lavoiser je na podlagi poznavanja vloge kisika v izgorevanju ugotovil, da je povečanje telesne mase v zgorevanju posledica vključitve kisika v izgorevanje materiala. Koncept kovinskih oksidov se je rodil.
Zato je vsota mase kovin, ki so bila podvržena zgorevanju in kisiku, ostala nesprejemljiva. Ta sklep je omogočil vzpostavitev zakona o ohranjanju množice.
-Uravnoteženje enačb
Zakon o ohranjanju množice je določil potrebo po uravnoteženju kemijskih enačb, kar je zagotovilo, da je število vseh elementov, ki sodelujejo v kemični reakciji, pa tudi reagenti ali izdelki, popolnoma enaki.
To je bistvena zahteva za natančnost stehiometričnih izračunov.
-Izračuni
Moli vode
Koliko molov vode se lahko pojavi med zgorevanjem 5 molov metana v presežku kisika? Dokazuje tudi, da je zakon o ohranjanju snovi izpolnjen.
Pogl4 + 2 o2 => Co2 + 2 h2Tudi
Če opazimo uravnoteženo enačbo reakcije, je sklenjeno, da 1 mol metana proizvaja 2 mola vode.
Težavo je mogoče rešiti neposredno s preprostim pristopom, saj nimamo 1 mol, ampak 5 molov CHO4:
Moli vode = 5 molov CHO4· (2 mola h2O / 1 mol Cho4)
= 10
Kaj bi bilo enakovredno 180 g H2Tudi. Ustanovljen je bil tudi 5 mol ali 220 g CO2, ki je enaka skupni masi 400 g izdelkov.
Tako za zakon ohranjanja subjekta reagira 400 g reagentov; nič več. Od teh 400 g, 80 g ustreza 5 moli CHO4 (Pomnoževanje z molekulsko maso 16 g/mol) in 320 g pri 10 moli O2 (Podobno zaradi molekulske mase 32 g/mol).
Izgorevanje magnezijevega traku
1,50 g magnezijevega traku je zgorel v zaprti posodi, ki vsebuje 0,80 g kisika. Po zgorevanju je bilo v posodi 0,25 g kisika. a) Kaj je reagirala masa kisika? b) koliko je nastalo magnezijev oksid?
Vam lahko služi: hipotonična rešitev: komponente, priprava, primeriKisikova masa, ki je reagirala, dobimo s preprosto razliko.
Porabljena masa kisika = (začetna masa - preostala masa) kisik
= 0,80 g - 0,25 g
= 0,55 g oz2 (do)
V skladu z zakonom o ohranjanju množice,
Masa magnezijevega oksida = magnetna masa +masa kisika
= 1,50 g + 0,55 g
= 2,05 g mgO (b)
Zakon o določenih razmerjih
Joseph Louis Proust (1754-1826), francoski kemik, je spoznal, da v kemični reakciji kemični elementi vedno reagirajo v fiksni masni deleži, da tvorijo spojino Čisto specifično; Zato je njegova sestava konstantna, ne glede na vir ali izvor ali kako se sintetizira.
Proust je leta 1799 izjavil zakon o določenih razmerjih, ki navaja, da: "Ko sta dva ali več elementov združena, da tvorita spojino, to storijo v fiksni masni zvezi". Torej je to razmerje fiksno in ni odvisno od strategije, ki ji sledi pri pripravi spojine.
Ta zakon je znan tudi kot zakon stalne sestave, ki navaja, da: "Vsaka kemična spojina v čistosti vedno vsebuje enake elemente v stalnem deležu mase".
-Ilustracija zakona
Železo (vera) reagira z žveplom (S), da tvori železov sulfid (FES), lahko se označi tri situacije (1, 2 in 3):
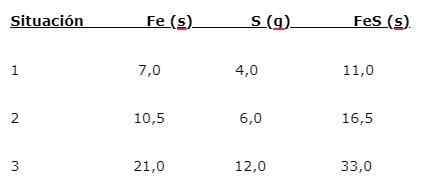
Če želite najti delež, v katerem so elementi združeni, je glavna masa (vera) razdeljena z manjšimi masami. Izračun daje delež 1,75: 1. Ta vrednost se ponovi v treh danih pogojih (1, 2 in 3), kjer se pridobi enak delež, čeprav se uporabljajo različne mase.
To pomeni, da je 1,75 g vere združenih z 1,0 g S, da bi dali 2,75 g FES.
-Prijave
S pomočjo tega zakona lahko natančno poznate množice elementov, ki jih je treba kombinirati, da dobite želeno maso spojine.
Na ta način lahko dobimo informacije o ostanku mase katerega koli elementa, ki sodelujejo v kemični reakciji, ali če v reakciji obstaja omejujoči reagent.
Poleg tega velja za poznavanje kontezimalne sestave spojine in na podlagi slednjega lahko vzpostavimo formulo spojine.
Centesimalna sestava spojine
Ogljikov dioksid (co2) nastane v naslednji reakciji:
C +o2 => Co2
12 g ogljika 32 g kisika se kombinira, da se da 44 g ogljikovega dioksida.
Torej je odstotek ogljika enak
Odstotek ogljika = (12 g / 44 g) · 100 %
= 27,3 %
Odstotek kisika = (32 g / 44 g) · 100 %
Odstotek kisika = 72,7 %
Z izjavo o zakonu o stalni sestavi je mogoče opozoriti, da ogljikov dioksid vedno tvori 27,3 % ogljika in 72,7 % kisika.
-Izračuni
Trioksid žvepla
Z reakcijo v različnih posodah 4 g in 6 g žvepla (S) s kisikom (O) so jih dobili 10 g in 15 g žveplovega trioksida (Torej3).
Zakaj so bile takšne količine žveplovega trioksida in ne drugih?
Izračunajte tudi količino žvepla, ki je potrebna za kombiniranje s 36 g kisika in pridobljenim testom za trioksid z žveplom.
Del A)
V prvi posodi se 4 g g kisika meša, da dobimo 10 g trioksida. Če se uporablja zakon o ohranjanju mase, lahko očistimo kisikovo maso, ki je bila kombinirana z žveplom.
Masa kisika = 10 g kisikovega trioksida - 4 g žvepla.
= 6 g
V zabojniku 2 6 g žvepla mešamo z x g kisika, da dobimo 15 žveplov trioksid.
Masa kisika = 15 g žveplovega trioksida - 6 g žvepla
= 9 g
Nato se izračunajo deleži o/s za vsako vsebnik:
Delež o / s v situaciji 1 = 6 g o / 4 g s
= 1,5 / 1
Delež o / s v situaciji 2 = 9 g o / 6 g s
= 1,5 / 1
Ki se strinja s tistim, kar je v zakonu opredeljenih razmer, ki kažejo, da so elementi vedno kombinirani v istem deležu, da tvorijo določeno spojino.
Zato so dobljene vrednosti pravilne in tiste, ki ustrezajo uporabi zakona.
Del B)
V prejšnjem razdelku je bila izračunana vrednost 1,5 / 1 za delež o / s.
Vam lahko služi: stanja združevanja snovig žvepla = 36 kisika · (1 g žvepla / 1,5 g kisika)
= 24 g
g žveplovega trioksida = 36 g kisika + 24 g žvepla
= 60 g
Klor in magnezij
Klor in magnezij sta združeni v deležu 2,95 g klora za vsak g magnezija. a) Določite mase klora in magnezija, potrebnih za pridobitev 25 g magnezijevega klorida. b) Kolikšen je odstotek sestave magnezijevega klorida?
Del A)
Na podlagi vrednosti 2,95 za razmerje CL: MG je mogoče izvesti naslednji pristop:
2,95 g Cl +1 g Mg => 3,95 g Mgcl2
Nato:
g Cl = 25 g mgcl2 · (2,95 g Cl / 3,95 g mgcl2)
= 18,67
G mg = 25 g mgcl2 · (1 g mg / 3,95 g mgcl2)
= 6,33
Nato je 18,67 g klora kombinirano s 6,33 g magnezija, da nastane 25 g magnezijevega klorida.
Del B)
Molekularna masa magnezijevega klorida, mgcl se najprej izračuna2:
MGCL molekularna teža2 = 24,3 g/mol + (2 · 35,5 g/mol)
= 95,3 g/mol
Magnezijev odstotek = (24,3 g / 95,3 g) x 100 %
= 25,5 %
Klorin odstotek = (71 g / 95,3 g) x 100 %
= 74,5 %
Zakon več razsežnosti ali zakon Daltona
Zakon je leta 1803 navedel francoski kemik in meteorolog John Dalton, ki temelji na njegovih opažanjih glede reakcij atmosferskih plinov.
Zakon je bil naveden na naslednji način: "Ko se elementi združijo, da dajejo več kot eno spojino, se spremenljiv masa enega od njih pridruži fiksni masi drugega in prvi ima kot odnos kanonov in nejasnih števil".
Tudi: "Ko sta dva elementa združena, da povzročita različne spojine, glede na fiksno količino enega od njih, so različne količine drugega elementa, ki so združeni s tistim fiksnim zneskom za izdelavo spojin, glede na preproste celotne številke".
John Dalton je prvi sodobni opis atoma naredil kot sestavni del kemičnih elementov, ko je poudaril, da elementi tvorijo nevidni delci, imenovani atomi.
Poleg tega je predlagal, da se spojine tvorijo, ko se atomi različnih elementov medsebojno združujejo v razmerjih preprostih številk.
Dalton je zaključil Proust -ova raziskovalna dela. Opozoril je na obstoj dveh kositrnih oksidov z odstotki 88,1% in 78,7% kositra z ustreznimi odstotki kisika, 11,9% oziroma 21,3%.
-Izračuni
Voda in vodikov peroksid
Pokažite, da vodne spojine, h2Ali, in vodikov peroksid, h2Tudi2, V skladu z zakonom več razsežnosti.
Atomske mase elementov: H = 1 g/mol in kisik = 16 g/mol.
Molekularni pesos spojin: h2O = 18 g/mol in h2Tudi2 = 34 g/mol.
Vodik je element s fiksno količino v h2Ali in h2Tudi2, Torej bodo deleži med O in H vzpostavljeni v obeh spojinah.
Razmerje O/H v H2O = (16 g/mol)/(2 g/mol)
= 8/1
Razmerje O/H v H2Tudi2 = (32 g/mol)/(2 g/mol)
= 16/1
Razmerje med obema proporcijama = (16/1)/(8/1)
= 2
Nato je razmerje med OR med vodikovim peroksidom in vodo 2, celo število in preprosto število. Dokazano je skladnost z zakonom več razsežnosti.
Dušikovi oksidi
Kaj kisikova masa je v kombinaciji s 3,0 g dušika v a) dušikovem oksidu, NO in B) dušikovem dioksidu, št2. Pokažite, da ne in ne2 V skladu z zakonom več razsežnosti.
Dušikova masa = 3 g
Atomske teže: dušik, 14 g/mol in kisik, 16 g/mol.
Izračuni
V NO je atom N kombiniran z 1 atomom O, tako da lahko kisikova masa, ki je v kombinaciji s 3 g dušika, izračuna z naslednjim pristopom:
G O = G dušika · (PA. O / pa. N)
= 3 g · (16 g/mol/14 g/mol)
= 3,43 g oz
V št2, Atom N je kombiniran z 2 atomi O, zato je masa kisika, ki je kombinirana,:
g kisika = 3 g · (32 g/mol/14 g/mol)
= 6,86 g oz
Delež o/ n pri NO = 3,43 g o/ 3 g n
= 1,143
Delež ali/n v št2 = 6,86 g o / 3 g n
= 2,282
Vrednost razmerja med razmerji o / n = 2.282 / 1,143
= 2
Nato je vrednost razmerja med razmerji ali/n 2, celo število in preprosto število. Zato je zakon o več razmerjih izpolnjen.
Zakon vzajemnih razsežnosti
Ta zakon, ki sta ga oblikovala Richter in Carl F. Wenzel ločen.
Vam lahko služi: natrij: zgodovina, struktura, lastnosti, tveganja in uporabeNa primer, če imate dve spojini AB in CB, opazimo, da je skupni element B.
Richter-Wenzel zakon ali vzajemni razmer pravi, da, če vemo, koliko A reagira z B, da daje AB, in koliko C reagira z B, da daje CB, lahko izračunate maso, katere je potrebna za reagiranje s C maso na C na CB obliko ac.
Rezultat pa je, da mora biti sorazmeren: C ali A/C večkratni ali podštevilni A/B ali C/B. Vendar ta zakon ni vedno izpolnjen, zlasti kadar elementi predstavljajo več oksidacijskih stanj.
Od vseh zakonov o teži je to morda najbolj "abstraktno" ali zapleteno. Če pa bomo analizirali z matematičnega vidika, bo to videti le iz faktorjev pretvorbe in odpovedi.
-Primeri
Metan
Če je znano, da 12 g ogljika reagira z 32 g kisika, da tvori ogljikov dioksid; in da na drugi strani 2 g vodika reagira s 16 g kisika, da tvori vodo, nato pa lahko ocenimo masni delež c/o in h/ali za CO2 in h2Ali oziroma.
Izračun c/o in h/ali imate:
C / o = 12G C / 32G oz
= 3/8
H / o = 2g h / 16g oz
= 1/8
Kisik je pogost element in želeti je vedeti, koliko ogljika reagira z vodikom, da proizvaja metan; To pomeni, da želite izračunati c/h (ali h/c). Potem je treba narediti delitev prejšnjih razsežnosti, da bi pokazali, ali je vzajemnost izpolnjena ali ne:
C/h = (c/o)/(h/o)
Upoštevajte, da na ta način OS prekliče in C/H ostane:
C/h = (3/8)/(1/8)
= 3
In 3 je 3/8 več (3/8 x 8). To pomeni, da 3 g C reagira z 1 g H, da daje metan. Ampak, da ga lahko primerjate s CO2, Pomnožena je c/h do 4, kar je enako 12; To daje 12 g C, ki reagira s 4 g H, da tvori metan, kar je tudi res.
Magnezijev sulfid
Če je znano, da 24 g magnezija reagira z 2 g vodika, da tvori magnezijev hidrid; Poleg tega 32 g žvepla reagira z 2 g vodika, da tvori vodikov sulfid, skupni element je vodik in želi izračunati mg/s iz mg/h in h/s.
Nato izračunate mg/h in h/s ločeno:
Mg / h = 24g mg / 2g h
= 12
H / s = 2g h / 32g s
= 1/16
Vendar je priročno uporabiti s/h za preklic h. Zato je S/H enak 16. Naredimo to, nadaljujemo z izračunom mg/s:
Mg/s = (mg/h)/(s/h)
= (12/16)
= 3/4
In 3/4 je podmestnik 12 (3/4 x 16). Delež Mg/s kaže, da 3 g mg reagira s 4 g žvepla, da tvori magnezijev sulfid. Vendar morate Mg/s pomnožiti z 8, da ga lahko primerjate z Mg/h. Tako 24 g mg reagira z 32 g žvepla, da da ta kovinski sulfid.
Aluminijev klorid
Znano je, da 35,5 g CL reagira z 1 g H, da tvori HCl. Tudi 27 g Al reagira s 3 g H, da tvori ALH3. Izračunajte delež aluminijevega klorida in povejte, če takšna spojina upošteva zakon Richter-Wenzel.
Spet se CL/H in AT/H izračunata ločeno:
Cl / h = 35,5g Cl / 1g h
= 35,5
At/ h = 27g at/ 3g h
= 9
Zdaj se izračuna na/cl:
At/cl = (al/h)/(cl/h)
= 9/35.5
≈ 0,250 ali 1/4 (dejansko je 0,253)
To pomeni, da 0,250 g Al reagira z 1 g Cl, da tvori ustrezno sol. Toda spet ga je treba pomnožiti na/cl s številko, ki omogoča primerjavo (za udobje) z Al/H.
Neprimisitve v izračunu
Nato se pomnoži na/cl z 108 (0,27/250), od tega 27 g reagira z 108 g Cl. To se ne zgodi natančno. Če za primer vzamemo vrednost 0,253 z AL/CL in jo pomnožimo za 106,7 (27/0,253), 27 g Al reagira z 106,7 g Cl; Ki se bolj približa resničnosti (alcl3, s PA 35,5 g/mol za CL).
Tu je opaziti, kako lahko Richterjev zakon začne zamahniti zaradi natančnosti in zlorabe decimalk.
Reference
- Whitten, Davis, Peck & Stanley. (2008). Kemija. (8. izd.). Cengage učenje.
- Rože, j. Kemija (2002). Uredništvo Santillana.
- Joaquín San Frutos Fernández. (s.F.). Teža in volumetrični zakoni. Okrevano od: encina.pntic.Mec.je
- Toppr. (s.F.). Zakoni kemijske kombinacije. Okrevano od: toppr.com
- Briljantno. (2019). Zakoni kemijske kombinacije. Okreval od: briljantno.org
- Kemija librettexts. (15. julij 2015). Temeljni kemični zakoni. Okrevano od: kem.Librettexts.org
- Čelada, Anne Marie, ph.D. (18. januar 2019). Zakon o ohranjanju mase. Okreval od: Thoughtco.com
- « Osvajanje odkritja Kolumbije, oder, posledice
- 9 delovnih rezultatov kariere poslovne administracije »

