Krom (cr)

- 4747
- 1037
- Roman Schamberger
 Chrome je zelo reaktivna kovina. Wikimedia Commons
Chrome je zelo reaktivna kovina. Wikimedia Commons Kaj je krom?
On krom (CR) je kemični element skupine 6 (VIB) periodične tabele. Tone te kovine letno nastanejo z ekstrakcijo minerala kromita ali magnezija (FECR2Tudi4, MGCR2Tudi4), ki se zmanjšajo s premog, da dobijo kovino. Je zelo reaktiven in le v zelo zmanjšanih pogojih je v svoji čisti obliki.
Njeni minerali in oksidi, pa tudi majhen kovinski bakreni porciji, ta element zaseda številko 22 najpogostejših zemeljskih skorje.
Kemija kroma je zelo raznolika, saj lahko tvori povezave s skoraj celotno periodično tabelo. Vsaka od njenih spojin ima barve, ki so odvisne od oksidacijske številke, pa tudi od vrst, ki z njim delujejo.
Prav tako oblikujte povezave do ogljika, ki posegajo v veliko število organometalnih spojin.
Krome značilnosti in lastnosti
Krom je srebrna kovina v svoji čisti obliki, z atomsko številko 24 in molekulsko maso približno 52 g/mol (52Cr, njen najbolj stabilen izotop).
Glede na svoje močne kovinske povezave predstavlja fuzijske točke (1907 ° C) in vrenje (2671 ° C) visoko. Tudi njegova kristalna struktura je zelo gosta kovina (7.19 g/ml).
Ne reagira z vodo, da tvori hidrokside, ampak s kislinami. Oksidira s kisikom zraka, ki običajno proizvaja kromični oksid, ki je široko uporabljen zeleni pigment.
Te plasti oksida ustvarjajo tisto, kar je znano kot Pasivacija, Zaščita kovine pred poznejšimi korozijami, saj kisik ne more prodreti v kovinski sinus.
Njegova elektronska konfiguracija je [AR] 4S13D5, Z vsemi manjkajočimi elektroni in zato ima paramagnetne lastnosti. Vendar pa lahko parjenje elektronskih vrtljajev pride, če je kovina podvržena nizkim temperaturam, pri čemer pridobi druge lastnosti, kot je antiferromagnetizem.
Vam lahko služi: ognjevzdržni materialiKemična struktura kromiranja
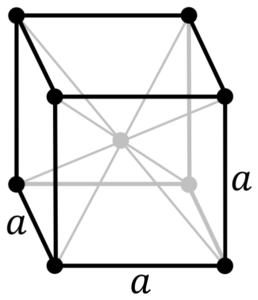 Kromirana kovinska struktura. Vir: avtor Original PNGS Daniel Mayer, Drbob, Wikimedia Commons
Kromirana kovinska struktura. Vir: avtor Original PNGS Daniel Mayer, Drbob, Wikimedia Commons Kakšna je struktura kromirane kovine? Chromium v svoji čisti obliki sprejme kubično kristalno strukturo, osredotočeno na telo (CC ali BCC). To pomeni, da je atom Chrome nameščen v središču kocke, katere robove zasedajo drugi kromi (kot na vrhunski sliki).
Ta struktura je odgovorna za krom, ki ima visoke točke in vrelišča, pa tudi veliko trdoto. Bakreni atomi se prekrivajo njihove orbitale S in D, da tvorijo gonilne pasove v skladu s teorijo pasov.
Tako sta oba pasova polna na polovici, ker je njihova elektronska konfiguracija [AR] 4S13D5, In kot orbital S lahko imata dva elektrona in orbitale deset. Nato le polovico pasov, ki jih tvorijo njihovi prekrivali, zasedajo elektroni.
S tema dvema perspektivama -kristalno strukturo in kovinsko povezavo -veliko fizičnih lastnosti te kovine je mogoče razložiti teoretično. Vendar niti ne pojasnjuje, zakaj ima Chrome več stanj ali oksidacijske številke.
Za to je globoko razumevanje stabilnosti atoma glede na elektronske vrtljaje.
Številka oksidacije kromiranja
Ker je kromirana elektronska konfiguracija [AR] 4S13D5 Lahko osvojite do enega ali dveh elektronov (CR1- in cr2-) ali jih izgubiti za pridobivanje različnih oksidacijskih številk.
Če torej krom izgubi elektron, bi bil kot [ar] 4s03D5; Če izgubite tri, [ar] 4s03D3; In če jih izgubite vse, [ar] ali kaj je enako, bi bilo izolektronsko do argona.
Vam lahko služi: vrelišče: koncept, izračun in primeriKromij zaradi zgolj muha ne izgubi ali pridobi elektronov: Obstajati mora vrsta, ki bi jih storila ali sprejeti, da gredo od ene oksidacijske številke na drugo.
Kromije ima naslednje oksidacijske številke: -2, -1, 0, +1, +2, +3, +4, +5 in +6. Od njih +3, cr3+, Je najbolj stabilen in zato prevladuje od vseh; sledi +6, cr6+.
Chrome uporablja
Kot barvilo ali pigment
Krom ima široko paleto aplikacij, od barvila za različne vrste tkanin, do zaščitnika, ki polepša kovinske koščke, kar je znano kot kromirano, kar lahko storite s čistimi kovinami ali s CR spojinami (III) ali CR (Vi).
Cromski fluoruro (CRF3), na primer, se uporablja kot barvilo za volnene krpe; Kromni sulfat (cr2(SW4)3), usojeno je barvati emajle, keramiko, slike, črnila, lake in služiti tudi za kromarjeve kovine; in kromični oksid (Cr2Tudi3) Poiščite tudi uporabo, kjer je potrebna njena privlačna zelena barva.
Zato je lahko kateri koli kromirani mineral z intenzivnimi barvami namenjen barvanju strukture, po tem pa dejstvo, ali so te spojine nevarne ali ne za okolje ali za zdravje posameznikov.
Pravzaprav se njegove strupene lastnosti uporabljajo za ohranjanje lesa in drugih napadov žuželk.
V kromed ali metalurgiji
Prav tako se dodajo majhne količine kroma do jekla, da ga okrepijo ob oksidaciji in izboljšajo njegovo svetlost. To je zato, ker je sposoben oblikovati sive karbide (CR3C2) Zelo odporen pri reakciji s kisikom zraka.
Vam lahko služi: kalcijev hidroksid (Ca (OH) 2): struktura, lastnosti, pridobivanje, uporabeKer lahko krom polira do svetlih površin, Chrome nato predstavlja srebrne modele in barve kot cenejšo alternativo za te namene.
Prehransko
Nekaj razprav, če lahko krom obravnavamo kot bistveni element, to je nepogrešljivo pri vsakodnevni prehrani. V nekaterih živilih je prisoten v zelo majhnih koncentracijah, kot so zeleni listi in paradižnik.
Obstajajo tudi beljakovinski dodatki, ki uravnavajo aktivnost inzulina in dajejo prednost rasti mišic, kot je to pri kromiranem polikotinatu.
Kje je krom?
Krom najdemo v številnih mineralih in draguljih, kot so rubini in smaragdi. Glavni mineral, iz katerega se izvleče kromit, je kromit (mcr2Tudi4), Kjer je lahko M katero koli drugo kovino, s katero je povezan kromni oksid. Te rudnike obilujejo v Južni Afriki, v Indiji, Turčiji, na Finskem, v Braziliji in drugih državah.
Vsak vir ima eno ali več kromitnih različic. Na ta način za vsak M (vera, MG, MN, Zn itd.) Pojavi se drugačen kromiran mineral.
Za ekstrahiranje kovine je potrebno. To se naredi z ogljikom ali aluminijem:
Fecr2Tudi4 + 4C => fe + 2cr + 4co
Prav tako najdemo kromito (pbcro4).
Ponavadi v katerem koli mineralu, kjer je ion cr3+ lahko nadomesti al3+, Oba z nekoliko podobnimi ionskimi radijskimi sprejemniki predstavljata nečistočo, ki ima za posledico drug naravni vir te neverjetne, a škodljive kovine.
Reference
- Tenebaum e. Krom. Vzeto iz: Kemija.Pomona.Edu
- Kemija librettexts. Kemija kroma. Vzet od: kem.Librettexts.org
- Krom. Vzeto od: ChemistryExplaed.com

