Osnove, vrste, vrste, aplikacije

- 4531
- 664
- Adrian Legros
The Coulombimetrija Gre za tehniko elektrokemijske analize, ki je sestavljena iz izčrpne elektrolize, tako da je mogoče analit količinsko določiti; to je določitev koncentracije analita v težavah s popolno oksidacijo ali zmanjšanjem. Za razliko od potenciometrije je dinamična tehnika, saj je tok dovoljeno, da se prosto teče skozi elektrokemične celice.
Kot že ime pove, se električni naboj Q v Coulomb enotah, C izmeri in korelira s koncentracijo oksidiranega ali zmanjšanega analita v periferiji elektrode. Zato se oksidacijska stanja spremembe analita, ki se pojavijo v postopku, prenos in absorpcija elektronov, ki omogoča stehiometrični izračun želene koncentracije.
 Rudimentarni sklop za elektrolizo, v kateri nastane več barvitih vrst zaradi pH in kompleksnosti prisotnih gozdarjev. Vir: Steve Jurvetson iz Menlo Park, ZDA, CC do 2.0, prek Wikimedia Commons
Rudimentarni sklop za elektrolizo, v kateri nastane več barvitih vrst zaradi pH in kompleksnosti prisotnih gozdarjev. Vir: Steve Jurvetson iz Menlo Park, ZDA, CC do 2.0, prek Wikimedia Commons V kulombimetriji se baterija ali potenciostat uporablja za nadzor toka ali potenciala, ki se uporablja za celice. Te celice, za razliko od potenciometrične.
Coulombimetrija predstavlja prednost, da lahko izvajate stopnje brez priprave ali standardizacije vzorcev. Omogoča tudi količinsko določitev zelo majhnih in omejenih količin analita, kot so kovinski kationi, anorganske spojine in organske spojine. Na primer, obstaja kulometer, zasnovan izključno za merjenje CO2 raztopljen v vzorcih iz oceana.
Ta tehnika ponuja drugačno analitično pot kot volumetrična in potenciometrična, toliko analiz, odvisno od elektrokemične narave analita, lahko razvije kulombimetrično.
Teoretične temelje kulombimetrije
Faraday zakon
Coulombimetrija temelji na Faradayjevem zakonu, ki vzpostavlja razmerje med električnim nabojem elektrokemične celice in količino analita, ki oksidira ali zmanjšuje. Poznavanje te obremenitve Q, pa tudi obremenitev elektrona (1.6 · 10-19 C), lahko izračunate število elektronov, vključenih v reakcijo, nin-:
nin- = Q/e
Po drugi strani je znano, da je en mol elektronov (6.02 · 1023) Porta Električni naboj, ki je enak 96485 C, je številka, znana kot Faraday Constant:
F = inDo
= 96485.3365 c/mol
Je primerno izraziti količino elektronov, odvisno od molov. Zahvaljujoč temu se lahko uporabijo stehiometrični koeficienti elektrokemične reakcije, oksidacija ali zmanjšanje, ob upoštevanju, koliko molov elektronov osvoji ali izgubi vrsto.
Vam lahko služi: natrijev fosfat: struktura, lastnosti, sinteza, uporabaOsnovni izračuni
Na primer, razmislite o naslednji kemični enačbi:
Ox + 2E- → omrežje
Če merimo, ko se celotna vrsta volov zmanjša na omrežje, lahko izračunamo molove vola z uporabo pretvorbenih faktorjev:
xq · (mol e- /96485.3365 c) · (mol ox/ 2mol e-) = mol vol
Se pravi, kot poznamo električni naboj za mol elektronov, bomo imeli, koliko elektronov ustreza obremenitvi xq. Toda vsaka 2 mola teh elektronov se uporabljata za oksidacijo 1 mol vola.
Ta sklep povzroča neposredno formulo, tudi če se ne priporoča, da si ga zapomni, ampak da jo lahko sklepate, kot je bilo storjeno:
n = Q/(fñin-)
Kje ñin- To je število molov elektronov v kemični enačbi.
Pod pogojem, da ga je mogoče izračunati, ne glede na vrsto kulombimetrije, lahko določimo moles vola ali omrežja; Dokler je učinkovitost toka 100%. Slednje pomeni, da mora biti vsa obremenitev, ki mora biti produkt samo ene transformacije, ne da bi se druge vrste zmanjšale ali oksidirale.
Eksperimentalni temelji kulombimetrije
Celice
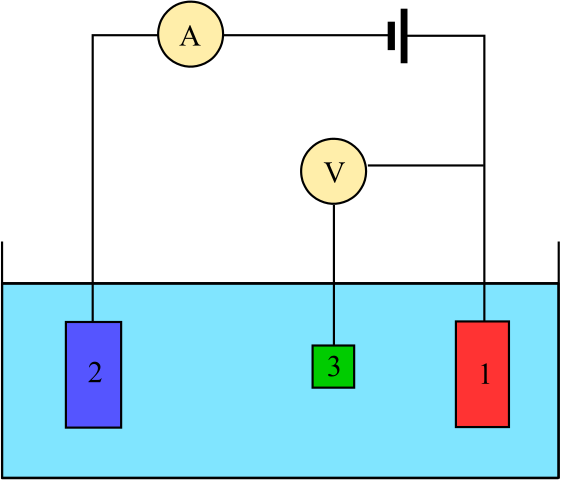 Diagram za elektrokemijsko celico, sestavljeno iz treh elektrod: referenca (3), asistenta (2) in dela (1). Vir: Adam Rędzikowski, CC BY-SA 3.0, prek Wikimedia Commons
Diagram za elektrokemijsko celico, sestavljeno iz treh elektrod: referenca (3), asistenta (2) in dela (1). Vir: Adam Rędzikowski, CC BY-SA 3.0, prek Wikimedia Commons Up imamo diagram za celico s tremi elektrodami, ki se običajno uporablja pri kulombimetričnih analizah. Redoks reakcija poteka med delovnimi elektrodami (1) in pomožno (2). Med njimi sta dva priključena na baterijo, da bi potenciale uporabili za celico in ampermeter (a) za merjenje električnih tokov.
Vendar pa je potrebna referenčna elektroda (3), da lahko spremljate potencial delovne elektrode in s tem poznate spreminjanje potenciala pomožne elektrode. Na ta način je mogoče določiti potencial celotne celice incelica, potrebno za oceno konca redoks reakcij v eni od vrst kulombimetrije.
Upoštevajte, da med delovno elektrodo in referenčno elektrodo skoraj ne pretaka toka zaradi voltmetra visoke impedance (v), zahvaljujoč branju potenciala za delovno elektrodo. Med tema dvema elektrodama imamo sistem, podoben sistemu potenciometrične analize: je statičen in ne dinamičen.
Lahko vam služi: jedrska kemija: zgodovina, področje študija, območja, aplikacijePotencial
Kulombimetrija je tako rekoč, ki se izvaja za analitične in kvantitativne namene. Zato se govori o uporabi zunanjih potencialov, ki jih dobavlja baterija, za izvajanje ne -spontanih elektrokemijskih reakcij; Se pravi, tisti, ki imajo negativne potenciale.
Razmislite na primer naslednje reakcije, ki jih spremljajo njihovi potencialni standardi:
Cu2+ + 2e- ⇌ cu (s) eºmreža = +0.337 V
H2Ali ⇌ 1/2o2(g) + 2h+ + 2e- Eºmreža = +1.230 V
Je enačba globalne reakcije, enaka:
Cu2+ + H2Ali ⇌ cu (s) + 1/2o2(g) + 2h+ Eºmreža = -0.893 v
Baterija mora uporabiti potencial 0.893 V tako, da je mogoča bakrena elektroda in tvorba vodikovih ionov. Ta potencial je ecelica. Vendar je treba v praksi uporabiti potencial, večji od izračunanega, ker obstajajo potenciali, ki nasprotujejo evoluciji reakcije:
Incelica = Ekatoda - Inanoda - OP - IR - CP
Kje,
OP: Preveliko nalogo (kinetična pregrada)
IR: Ohmic (notranji potencial za celice)
CP: polarizacija koncentracij (produkt zmanjšanja Cu2+)
Vrste kulombimetrije
Obstajajo tri vrste kulombimetrije: amperostatična, potenciastična in elektrografska elektrogravimetrična.
Amperostatični ali galvanostatični
Pri tej vrsti kulombimetrije je tok, ki teče skozi celico, konstanten z uporabo amperostata. Zato ima tok Yo Hvala branju ampermetra in tudi poznavanje časa t Ko se elektroliza konča, lahko izračunamo obremenitev, ki je povezana s transformacijo analita:
Q = Predmet
Posledica ohranjanja trenutne konstante je, da elektrode potencialne spremembe, bodisi pozitivno ali negativno. Ta nenadna sprememba kaže, da se je analit popolnoma reagiral, to je, ko se elektroliza ustavi in se meri t. To je osnova za kulometrične stopnje.
Če se potencial nadaljuje ali nalaga, bodo druge nezaželene elektroaktivne vrste na koncu reagirale. Zato je treba potenciale, povezane s preobrazbami, ki jih zanimajo.
Potentiostatična
Eden od načinov za preprečevanje drugih vrst. Tukaj vstopi potenciosotska kulombimetrija, ker uporablja potenciostete, da nastavi določen potencial za celico. Za razliko od amperostatične kulombimetrije se zdaj s časom spreminja tok.
Vam lahko služi: toluen: struktura, lastnosti, uporabe, pridobivanjeZaradi te tehnične konfiguracije tega ne moremo izračunati neposredno z vrednostmi Yo in t; Tok se sčasoma zmanjšuje. To je zato, ker bo analit reagirala, manj in manj molekul ali atomov, ki donirajo ali sprejemajo elektrone. Zato je enako integralnemu območju pod grafično krivuljo Yo VS t.
Elektrograf
Elektrografska kulombimetrija, preprosto znana kot elektrogravimetrija, je elektroliza, pri kateri ni treba meriti obremenitve ali električne tokove. Namesto tega se mase elektrod merijo pred in po elektrolizi.
Ta tehnika velja samo, kadar so vrste, ki so zmanjšane, kovinski kationi, ki so elektrodepo na elektrodah, zaradi česar so težji.
Prijave
Potenciostetična
Potentiostetske analize omogočajo zmanjšanje ali oksidacijo selektivno eno vrsto naenkrat sredi mešanice. Na primer, uporabljajo se za določitev koncentracije naslednjih anorganskih ionov v sledovih ali v zapletenih matrikah:
-Cu2+
-As3+
-CD2+
-Co2+
-Vera2+ in vera3+
-Pb2+
-X (f-, Cl-, Br- in jaz-)
-Niti2+
-PU3+
-Ag+
-Sn2+
-Zn2+
-Ali6+
Tudi te analize lahko uporabimo za določitev sestave zlitine. Ko se kislina zlitina raztopi, se celični potenciali nanesejo na raztezan in nadzorovan način, s čimer določimo zmanjšano količino za vsak kovinski kation, ki ga integrira.
Kulometrične stopinje
V kulometričnih stopinjah se uporabljajo posredniška sredstva, ki poskrbijo, da se popolnoma nevtralizirajo ali reagirajo s preostalim analitom. Namen tega je preprečiti morebitne spremembe, ki so konstantni tok, izpeljani v kolateralnih reakcijah. Tako je možno držalo, na primer askorbinsko kislino, ki uporablja jod kot mediator.
Nekateri kovinski kationi, na primer Ag+, Ec3+, Vera3+, Mn2+, Ti3+, Cr2+, Določijo jih lahko tudi te stopnje.
Po drugi strani pa lahko to tehniko še vedno uporabljajo reakcije s kislinsko bazo, saj veliki potenciali povzročajo ionsko vodo3Tudi+ ali oh-, ki služijo iz naslovov, ki se nastajajo in situ; to pomeni, da bodo nevtralizirali kisline ali prisotne baze.
Co2 Oceana je mogoče analizirati tudi reakcije padavin in tvorbo kompleksov z EDTA z uporabo kulometričnih stopenj, kjer se dodajo redoks kazalniki, da poudarijo končno točko elektrolize.
Reference
- Dan, r., & Underwood, a. (1986). Kvantitativna analitična kemija (Peti izd.). Pearson Prentice Hall.
- Skoog d.Do., Zahod d.M. (1986). Instrumentalna analiza. (Drugi izd.). Inter -American., Mehika.
- Doktor. Doug Stewart. (2020). Opredelitev kulometrije. Okrevano od: Chemicool.com
- Wikipedija. (2020). Kulometrija. Pridobljeno iz: v.Wikipedija.org
- Harvey David. (5. junij 2019). Kulometrične metode. Kemija librettexts. Okrevano od: kem.Librettexts.org
- « Metodološki okvir, kako ga napisati, struktura, primeri
- Izvor sodobne filozofije, značilnosti, tokovi, avtorji »

