Hitrostna konstantna

- 2987
- 276
- Cary Goyette
Kakšna je hitrostna konstanta?
The hitrostna konstantna To je konstanta sorazmernosti zakona o hitrosti kemijske kinetike, ki vzpostavlja razmerje med molarno koncentracijo reagentov in hitrostjo reakcije.
Kot reagenti porabijo reakcijske hitrosti, se tudi zmanjšujejo. Zato se pri izračunih konstante hitrosti, ki jo predstavlja simbol 'K', upoštevajo začetne hitrosti, da se primerjajo med več poskusi.

Kemična kinetika kaže, da je ta konstanta odvisna od reakcijskih vrst reagentov, katerih koncentracije bodo spreminjale hitrost reakcije. Po drugi strani pa je po Arreniusovi enačbi K odvisen tudi od temperature in aktivacijske energije za reakcijo.
Zato se reče, da hitrostna konstanta ni resnična konstanta, saj se razlikuje glede na temperaturo in tudi s prisotnostjo katalizatorjev, ki spreminjajo aktivacijsko energijo. Zato ni veliko tabel, kjer pridejo po posebnih reakcijah (in pogojih).
Na primer, za reakcijo, kjer reagirajo A in B, vsaka z vrstnim redom 1, konstanto poročajo K do 25 ° C in z dodatkom določene količine katalizatorja ne bo enaka, če reakcija je narejen za temperaturo 26 ali 27 ° C. Najmanjša sprememba bo vplivala na vrednost K, ki je med pogoji, določenimi za poskuse, le konstantna.
Kako izračunati konstanto hitrosti?
Eksperimentiranje
Določitev vrednosti hitrostne konstante reakcije se izvede eksperimentalno. Če na primer želite določiti vrednost konstante hitrosti za reakcijo obrazca:
A +B → C
Za vzpostavitev vrednosti K lahko izvedemo tri reakcije z naslednjimi razlikami: v reakciji 2 je začetna koncentracija reagenta A konstantna, [a], vendar se podvoji, na primer koncentracija reagenta B, [ B].
Medtem se v reakciji 3 [a] podvoji v primerjavi z reakcijo 1, pri čemer ohranja konstantno [B].
Tako bo zgrajena tabela koncentracij, ki bo služila za primerjavo začetnih hitrosti med več poskusi. To z namenom določitve reakcijskih naročil in zaporedno izračunati konstanto hitrosti.
Vam lahko služi: aluminijev hidroksid: struktura, lastnosti, uporabe, tveganjaReakcijski naročili
Prvi izračun
Za prejšnjo reakcijo je njegova hitrost izražena z enačbo:
Reakcijska hitrost = k · [a]x· [B]in
Kjer 'x' e 'in' ustrezajo reakcijskim redom za reagente A in B.
Za določitev vrednosti reakcijskih vrst je treba narediti primerjavo med reakcijo 2 in 1 ter med reakcijo 3 in 1.
Če primerjamo reakcijo 1 z 2, lahko na primer opazimo, da s podvajanjem [b] obstaja podvajanje reakcijske hitrosti.
Nato: delež [B] med reakcijami 2 in 1 je 2, pa tudi delež med hitrostmi reakcij. Nato lahko vrednost vrstnega reda reakcije dobimo glede na B (eksponent in) z naslednjim pristopom:
 Izračun reakcijskega vrstnega reda 'in'. Vir: Gabriel Bolívar.
Izračun reakcijskega vrstnega reda 'in'. Vir: Gabriel Bolívar. Hitrost poskusa 2 je dvakrat hitrejša od hitrosti poskusa 1. Tako bomo z delitvijo obeh zgornjih enačb imeli:
2 = 2in
Zato, 'in' Vale 1, ki lahko sklepata, da je vrstni red reakcije glede reagenta B prvega reda.
Drugi izračun
Na enak način nadaljujemo z reagentom A za izračun 'x':
 Izračun vrstnega reda reakcije 'x'. Vir: Gabriel Bolívar.
Izračun vrstnega reda reakcije 'x'. Vir: Gabriel Bolívar. Hitrost poskusa ali reakcije 3 je štirikrat večja od poskusa ali reakcije 1. Zato:
4 = 2x
Tudi
22 = 2x
In vrednost x je 2, zato je reakcija drugi vrstni red glede na reagent do.
Končna čistila
Nato je mogoče določiti vrednost konstante hitrosti, ki temelji na kateri koli od reakcij:
Reakcijska hitrost = k · [a]2· [B]
Dovolj za uvedbo eksperimentalnih vrednosti in čistega k:
K = reakcijska hitrost / ([a]2· [B])
Primeri
Naslednji primeri služijo kot uvod, preden se vaje rešijo iz naslednjega razdelka.
Primer 1
V kemični reakciji:
a) Če se začetna koncentracija reagenta podvoji hitrost reakcije: kakšen je vrstni red reakcije glede tega reagenta?
b) Če povečanje koncentracije reagenta povzroči povečanje hitrosti pri faktorju 8?
c) Če koncentracija reagenta doživi spremembo in hitrost ostane enaka: kakšen je vrstni red reakcije glede na reagent?
Lahko vam služi: cikopropan (C3H6)V a) je delež reakcijskih hitrosti enak in delež koncentracij reagenta je enak 2x,
2 = 2x
Zato je x = 1 in vrstni red reakcije glede na reagent 1.
V b) je delež reakcijske hitrosti enak 8 (23) in delež koncentracij reagenta je enak 2x,
23 = 2x
Zato je x = 3 in vrstni red reakcije glede na reagent 3-
Medtem ko je v C) hitrost reakcije neodvisna od koncentracije reagenta, je torej vrstni red reakcije glede na reagent nič.
Primer 2
Reakcija:
2 Ne2 + Tudi2 → 2 št2
Ima izraz naslednjega zakona o hitrosti:
Reakcijska hitrost = k · [ne2]2· Tudi2.
Kakšen je globalni red reakcije? Kakšne enote bi imele k?
Vrstni red reakcije v zvezi z oz2 Je 1 in vrstni red reakcije glede na ne2 To je 2, zato je globalni vrstni red reakcije vsota teh vrednosti, torej 2 + 1 = 3.
Hitrost reakcije ima M/S enote, koncentracije reagentov pa so izražene v m. Naredili analizo enot, ki jih bomo imeli:
k = reakcijska hitrost / (ne2]2· [Bodisi2]
= (M / s) / (m3)
= s-1M-2
Rešene vaje
Vaja 1
Podatki naslednje reakcije so bili dobljeni pri 25 ° C:
A +2 B → C +2 D
Kakšen je izraz hitrostni zakon te reakcije? Kakšna je vrednost vaše konstante hitrosti?
Izračuni reakcijskih naročil
Eksperimentalni podatki so:
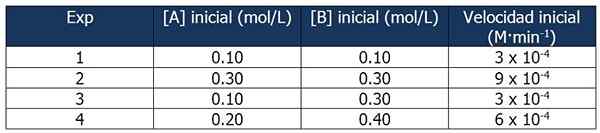 Cinetični podatki o vaji 1. Vir: Gabriel Bolívar.
Cinetični podatki o vaji 1. Vir: Gabriel Bolívar. Primerjava poskusov 1 in 3 vam omogoča, da sklepate naslednje zaključke:
Delež med hitrostjo reakcij 3 in 1:
3 x 10-4 M · min-1 / 3 x 10-4 M · min-1 = 1
Toda delež med koncentracijo B je:
(0.3 mol / l) / (0.1 mol/l) = 3
Hitrost reakcije je neodvisna od koncentracije B, saj njegovo povečanje ne vpliva. Zato je vrstni red reakcije glede na reagent B nič.
Po drugi strani primerjava reakcij 4 in 1 omogoča naslednje sklepe:
6 x 10-4 M · min-1 / 3 x 10-4 M · min-1 = 2
Medtem je delež med [a] reakcijami 4 in 1 enak:
Vam lahko služi: 5 značilnosti homogenih mešanic(0.20 mol / l) / (0.10 mol/l) = 2x
Potem bo odnos med razmerji:
2 = 2x
x = 1
Zato je izraz zakona o hitrosti:
Reakcijska hitrost = k · [a]
B se ne sprejme, ker je njen vrstni red reakcije nič.
Izračun k
Lahko izračunamo konstanto hitrosti iz katerega koli od kinetičnih podatkov. Uporabimo eksperiment 1:
K = reakcijska hitrost / [a]
= 3 x 10-4 M · min-1 / 0.10 m
= 3 x 10-3 ali 0.003 min-1
Vaja 2
Podatki o reakciji smo dobili pri določeni temperaturi.
2 clo2 (AC) +2 OH- (AC) → CLO3- (AC) +CLO2 (Ac) +h2Ali (l)
Izračuni reakcijskih naročil
Eksperimentalni podatki so:
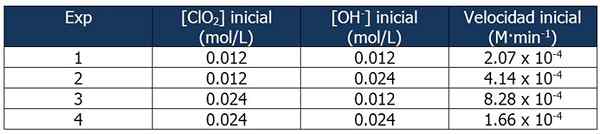 Cinetični podatki o vaji 2. Vir: Gabriel Bolívar.
Cinetični podatki o vaji 2. Vir: Gabriel Bolívar. Delež med hitrostjo reakcije 2 in reakcijo 1 je:
4.14 x 10-4 M · min-1 / 2.07 x 10-4 M · min-1 = 2
In delež koncentracij OH- Med reakcijami 2 in 1 je enako:
(0,024 mol/l)/(0,012 mol/l) = 2x
Eksponent 'x' predstavlja vrstni red reakcije glede na reagent OH-. Razmerje med izračunanimi deleži je lahko predstavljeno na naslednji način:
2 = 2x
x = 1
Zato vrstni red reakcije glede na reagent OH- je enak 1.
V reakciji 3 se koncentracija CLO podvoji2 reakcije 1, medtem ko koncentracija OH- Ostane konstanten.
Delež med hitrostjo reakcij 3 in 1:
(8.28 x 10-4 M · min-1) / (2.07 x 10-4 M · min-1) = 4 (22)
In delež [clo2] med reakcijami 3 in 1 je enako:
(0,024 mol/l)/(0,012 mol/l) = 2in
Eksponent 'in' predstavljata vrstni red reakcije glede reagenta CLO2.
Primerjava deleža:
22 = 2in
4 = 2in
y = 2
Zato je reakcija druga glede na reagent CLO2.
Izraz zakona o hitrosti bo potem:
Reakcijska hitrost = k · [clo2]2· [Oh-]
Izračun k
Ponovno lahko izračunamo K iz prejšnjega izraza s katerim koli od kinetičnih podatkov za poskuse. Uporabili bomo eksperiment 3:
K = (8.28 x 10-4 M · min-1) / (0.024 m)2 (0.012 m)
= 119.79 min-1· M-2
Reference
- Whitten, Davis, Peck & Stanley. (2008). Kemija. (8. izd.). Cengage učenje.
- Wikipedija. (2020). Konstantna hitrost reakcije. Pridobljeno iz: v.Wikipedija.org
- Kemija Texas A&M University. (s.F.). Kinetika: izračuni hitrosti vzorca. Okrevano od: kem.Tamu.Edu
- Keith J. Laidler. (2020). Hitrost reakcije. Britannica Encyclopeedia. Okrevano od: Britannica.com
- Čelada, Anne Marie, ph.D. (25. avgust 2020). Kakšna je konstantna hitrost v kemiji? Okreval od: Thoughtco.com
- Clark Jim. (2013). Konstante hitrosti in arrenijeva enačba. Okrevano od: Chemguide.co.Združeno kraljestvo

