Elektronska konfiguracijska konfiguracija jedra, primeri
- 4501
- 192
- Ignacio Barrows
The Jedra elektronska konfiguracija ali kompaktno je, čigar kvantni zapisi o številu elektronov in njihovih energijskih nivojev skrajšajo simboli plemenitih plinov v kvadratnih oklepajih. Zelo je uporaben pri pisanju elektronskih konfiguracij za določen element, saj je preprost in hiter.
Beseda "jedro" se običajno nanaša na elektronske notranje plasti atoma; Torej tisti, v katerih njihovi elektroni niso iz Valencije in zato ne sodelujejo v kemični vezi, čeprav opredeljujejo lastnosti elementa. Metaforično gledano bi bilo jedro notranjost čebule, z njegovimi plastmi, sestavljenimi iz niza rastočih orbital v energiji.
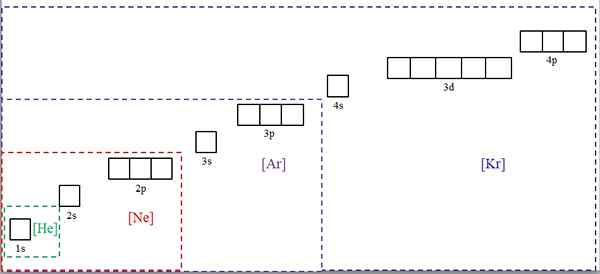
 Elektronske konfiguracije, skrajšane s simboli plemenitih plinov. Vir: Gabriel Bolívar.
Elektronske konfiguracije, skrajšane s simboli plemenitih plinov. Vir: Gabriel Bolívar. Vrhunska slika prikazuje kemične simbole za štiri plemenite pline v kvadratnih oklepajih in z različnimi barvami: [he] (zelena), [ne] (rdeča), [ar] (vijolična) in [KR] (modra) (modra).
Vsak od njenih pikčastih okvirjev vsebuje polja, ki predstavljajo orbitale. Večje, večje je število elektronov, ki vsebujejo; kar bo pomenilo, da je mogoče elektronske konfiguracije več elementov poenostaviti s temi simboli. To prihrani čas in energijo s pisanjem vseh zapisov.
[TOC]
Gradbeni red
Preden uporabite elektronske konfiguracije jedra, je primerno pregledati pravilen naročilo za izgradnjo ali pisanje teh konfiguracij. To se ureja v skladu z diagonalnim pravilom ali Moellerjevim diagramom (imenovan v nekaterih delih dežja). Če ima ta diagram pri roki, kvantni zapisi ostanejo na naslednji način:
1s 2s 2p 3s 3p 4s 3d 4p 5s 4d 5p 6s 4f 5d 6p 7s 5f 6d 7p
Vam lahko služi: osnovne soli: formula, lastnosti, nomenklatura, primeriTa vrsta kvantnih zapisov je videti izčrpana; In še bolj bi bilo, če bi ga morali ves čas napisati, da bi ga predstavljali elektronska konfiguracija katerega koli elementa, ki so ga našli v obdobju 5 naprej. Upoštevajte, da je vrstica prazna elektronov; Na pravicah z višjimi pravicami ni številk (1s22s22 p6…).
Ne pozabite, da orbitale s lahko "gosti" dva elektrona (ns2). Orbitale str Skupaj so tri (poglejte tri polja zgoraj), tako da lahko gostijo šest elektronov (NP6). In končno, orbitale d Obstaja pet in F sedem, skupno deset (ND10) in štirinajst (NF14) elektroni.
Okrajšava elektronske konfiguracije
Kljub temu je sprednja vrstica kvantnih zapisov napolnjena z elektroni:
1s2 2s2 2 p6 3s2 3P6 4s2 3D10 4p6 5s2 4d10 5 str6 6s2 4f14 5 d10 6p6 7s2 5f14 6d10 7p6
Koliko elektronov je skupaj? 118. In kateri element ustreza tako ogromni količini elektronov v njenem atomu? Do plemenitega oganskega plina, OG.
Recimo, da obstaja element s kvantno številko z, ki je enak 119. Potem bi bila njegova elektronska konfiguracija Valencia 8s1; Toda kakšna bi bila popolna elektronska konfiguracija?
1s2 2s2 2 p6 3s2 3P6 4s2 3D10 4p6 5s2 4d10 5 str6 6s2 4f14 5 d10 6p6 7s2 5f14 6d10 7p6 8s1
In kakšna bi bila vaša elektronska konfiguracija jedra, kompaktna? To:
[OG] 8s1
Upoštevajte očitno poenostavitev ali okrajšavo. V simbolu [OG] se šteje vseh 118 elektronov, tako.
Vam lahko služi: kaj je nasičena rešitev? (S primeri)Primeri
Splošno
Recimo zdaj, ko želite kratico izvajati postopoma:
[On] 2s2 2 p6 3s2 3P6 4s2 3D10 4p6 5s2 4d10 5 str6 6s2 4f14 5 d10 6p6 7s2 5f14 6d10 7p6
Upoštevajte, da 1s2 Nadomestil ga je [on]. Naslednji plemenit plin je neon, ki ima 10 elektronov. Če to vem, se okrajšava nadaljuje:
[NE] 3S2 3P6 4s2 3D10 4p6 5s2 4d10 5 str6 6s2 4f14 5 d10 6p6 7s2 5f14 6d10 7p6
Nato sledite Argonu z 18 elektroni:
[AR] 4S2 3D10 4p6 5s2 4d10 5 str6 6s2 4f14 5 d10 6p6 7s2 5f14 6d10 7p6
Ker je naslednji plemenit plin Kripton, je napredovalo še 36 elektronov:
[KR] 5S2 4d10 5 str6 6s2 4f14 5 d10 6p6 7s2 5f14 6d10 7p6
Xenon ima 54 elektronov, zato kratico premaknemo na 5P orbital:
[Xe] 6s2 4f14 5 d10 6p6 7s2 5f14 6d10 7p6
Na tej točki je elektronska konfiguracija vedno skrajšana na NP orbital; To pomeni, da imajo plemeniti plini te orbitale, polne elektronov. In končno sledite radonu z 86 elektroni, tako da skrajšamo na 6p orbital:
[RN] 7s2 5f14 6d10 7p6
Kisik
Kisik ima osem elektronov, saj je njegova popolna elektronska konfiguracija:
1s22s22 p4
Edina okrajšava, ki jo lahko uporabimo, je [on] do 1S2. Tako je njegova elektronska konfiguracija jedra:
[On] 2s22 p4
Kalij
Kalij ima devetnajst elektronov, saj je njegova popolna elektronska konfiguracija:
Vam lahko streže: od kod plastika? Zgodovina in vrste1s2 2s2 2 p6 3s2 3P6 4s1
Upoštevajte, da lahko s simbolom [on] skrajšamo to konfiguracijo; pa tudi [ne] in [ar]. Slednje je tisto, kar se uporablja, ker je argon plemenit plin, ki je pred tem najbližje kaliju. Zato ostaja njegova elektronska konfiguracija jedra:
[AR] 4S1
Indijanca
Indijanca ima štirideset -denine elektrone, saj je njegova popolna elektronska konfiguracija:
1s2 2s2 2 p6 3s2 3P6 4s2 3D10 4p6 5s2 4d10 5 str1
Ker je Kripton najbližji plemenit plin, ki je pred Indijcem, se uporablja simbol [KR] za okrajšavo, njegova elektronska konfiguracija jedra pa je:
[KR] 5S2 4d10 5 str1
Čeprav 4D orbitale formalno ne pripadajo indijskemu jedru, njihovi elektroni ne posredujejo (vsaj v normalnih pogojih) v svoji kovinski vezi, temveč tisti iz 5s in 5p orbital.
Volfram
Volfram (ali Wolframio) ima 74 elektronov, njegova popolna elektronska konfiguracija pa je:
1s2 2s2 2 p6 3s2 3P6 4s2 3D10 4p6 5s2 4d10 5 str6 6s2 4f14 5 d4
Spet iščemo najbližji plemenit plin. V njegovem primeru ustreza Xenónu, ki ima svoje 5P orbitale dokončano. Tako vrsto kvantnih zapisov zamenjamo s simbolom [XE] in končno bomo imeli njegovo jedro elektronsko konfiguracijo:
[Xe] 6s2 4f14 5 d4
Reference
- Shiver & Atkins. (2008). Anorganska kemija. (Četrta izdaja). MC Graw Hill.
- Whitten, Davis, Peck & Stanley. (2008). Kemija. (8. izd.). Cengage učenje.
- Pat Thayer. (2016). Diagrami konfiguracije elektronov. Okrevano od: ChemistryApp.org
- Čelada, Anne Marie, ph.D. (5. december 2018). Opredelitev jedra plemenitega plina. Okreval od: Thoughtco.com/
- Wikipedija. (2019). Elektronska konfiguracija. Okrevano od: je.Wikipedija.org

