Kemična koncentracija

- 1312
- 162
- Cary Goyette
 Kemična koncentracija je tisto, kar določa delež topila in topila v kemični raztopini
Kemična koncentracija je tisto, kar določa delež topila in topila v kemični raztopini Kaj je kemična koncentracija?
The Kemična koncentracija To je lastnost rešitev, ki predstavlja količino topljene za vsako enoto rešitve. Z drugimi besedami, to je številka, ki označuje delež, v katerem sta topilo in topilo.
Spomnimo se, da je raztopina homogena mešanica, ki jo tvori topilo (na splošno tekočina) in ena ali več snovi, raztopljenih v topilu. Za raztopine so značilni topilo, topilo in koncentracija.
Koncentracija je zelo uporabna lastnost, saj nam omogoča, da jih opišemo. Na primer, če vemo, da je koncentracija soli v morski vodi 35 gramov za vsak liter, potem vemo, da v naši hiši raztopimo 35 gramov soli v litru raztopine.
Značilnosti kemijske koncentracije
Je intenzivna lastnost
To je glavna značilnost koncentracije. Intenzivno pomeni, da ni odvisno od količine rešitve, ki jo imamo. Kot primer to pomeni, da je koncentracija enaka v kapljici morske vode kot v 100 litrih.
Se lahko razlikuje glede na temperaturo
Na splošno tekočine pri segrevanju širijo ali povečujejo svojo količino. To velja tudi za rešitve. Zaradi tega se koncentracije, izražene glede na volumen, lahko rahlo spremenijo pri segrevanju ali hlajenju raztopine.
Lahko pokrije zelo široke razpone
Ne glede na enote, v katerih je izražena kemična koncentracija, ima lahko od relativno velikih vrednosti do izjemno majhnih vrednosti.
Na primer, koncentracija raztopine, izražene v odstotkih. Lahko bi pripravili 90 -odstotno rešitev, saj bi lahko pripravili tudi eno za 10-12%, kar je skoraj 14 vrst manjšega obsega.
Kaj je kemična koncentracija za?
Poznavanje koncentracije rešitve nam omogoča, da jo opišemo. Obstaja veliko lastnosti rešitev, ki so odvisne od njihove koncentracije. Na primer, točka taljenja in vrelišča sta odvisna od koncentracije, zato vemo, da nam omogoča izračun teh dveh lastnosti.
Vam lahko služi: steklovinoPo drugi strani nam koncentracija omogoča enostavno primerjavo rešitve z drugo. Če imamo s sladkorjem dve vodni raztopini, nam bodo vedeli, da bodo njihove koncentracije vedeli, katera od obeh je slajša.
Poleg tega so vse kemijske reakcije, ki omogočajo življenje, močno odvisne od koncentracije neskončnih topljencev v celicah in okolici živih bitij.
Na primer, koncentracija kisika v zraku določa, ali bo oseba zadušila ali ne; PH raztopine (ki je način za merjenje koncentracije H ionov+) Določite, ali bodo bakterije živele in razmnoževale ali pa bo, nasprotno, umrlo; in koncentracija strupa bo ugotovila, ali bo smrtonosna ali ne.
Vrste koncentracijskih enot
Koncentracija raztopine je ena, zato ni pravilno govoriti o vrstah koncentracije. Vendar se lahko enaka koncentracija izrazi v različnih vrstah koncentracijskih enot. To so:
- Enote za fizično koncentracijo
- Kemične koncentracijske enote
Enote za fizično koncentracijo
Za njih je značilno izražanje količin topljene in topila v enotah mase ali volumna. Imenujejo se fizične enote, saj so namesto molov in enakovredne povezane z množicami in količino.
Ko primerjamo dve rešitvi, ki imata enako fizično koncentracijo, ne moremo zagotoviti, da imajo enake količine atomov in molekul. To jih razlikuje od enot kemijske koncentracije.
Najpogostejše fizične enote koncentracije so:
- Preprost naslov (TS)
- %Teža/teža (%P/P) ali masa/masa (%m/m)
- %Teža/volumna (%P/V) ali masa/volumna (%m/v)
- % Volumen/Volume (% v/v)
- Deli na milijon teže/teža (ppmp/p) ali masa/masa (ppmm/m)
- Deli na milijon teže/prostornine (ppmp/v) ali masa/volumen (ppmm/v)
- Deli na milijon prostornine/prostornina (ppmV/v)
Kemične koncentracijske enote
V primeru kemijskih enot se količina topljene in v nekaterih primerih topila ali raztopine izražajo v smislu števila delcev ali molov ali ekvivalentov, ki so prisotni v raztopini.
Imenujejo se kemijske enote, saj imata dve raztopini, ki imata enako kemično koncentracijo, enakovredne količine atomov, molekul ali topnih ionov na enoto raztopine.
Lahko vam služi: Pravila topnosti: Splošni vidiki in pravilaNajpogostejše kemijske enote so:
- Molarnost (m)
- Molalnost (m)
- Molarna frakcija (x)
- Normalnost (n)
Formula fizične koncentracijske enote
Preprost naslov (TS)
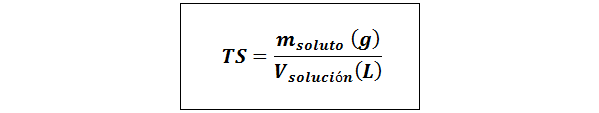
Kjer mtopilo predstavlja maso topila v gramih in vrešitev To je prostornina raztopine v litrih.
%Teža/teža (%P/P) ali masa/masa (%m/m)
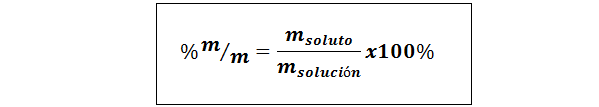
Kjer mtopilo in mrešitev oziroma predstavljajo maso topljene in rešitve. Lahko uporabimo katero koli enoto mase (g, mg, kg itd.), dokler sta obe masi izraženi v isti enoti.
%Teža/volumna (%P/V) ali masa/volumna (%m/v)
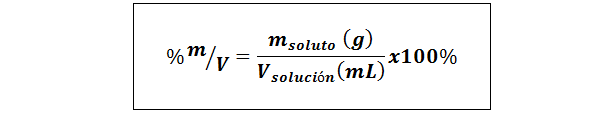
Kjer mtopilo Je masa raztopine v gramih in vrešitev To je prostornina rešitve, v tem primeru pri mililitrih.
% Volumen/Volume (% v/v)

Kjer vtopilo in vrešitev oziroma predstavljajo volumen topljene in rešitve. V tem primeru lahko za izražanje teh zvezkov uporabite katero koli enoto, če je enaka za oba.
Deli na milijon teže/teža (ppmp/p) ali masa/masa (ppmm/m)
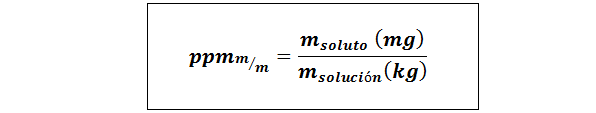
Kjer mtopilo in mrešitev Predstavljajo maso topljene in raztopine v miligramih oziroma kilogramov.
Deli na milijon teže/prostornine (ppmp/v) ali masa/volumen (ppmm/v)
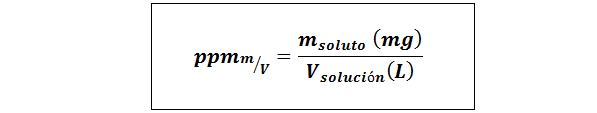
Kjer mtopilo Je masa raztopine v miligramih in Vrešitev To je prostornina rešitve, v tem primeru v litrih.
Deli na milijon prostornine/prostornina (ppmV/v)
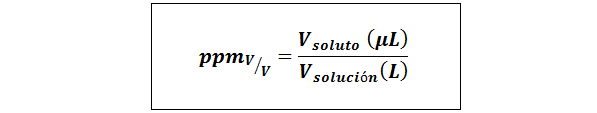
Kjer vtopilo in vrešitev So volumen topljene in raztopine v mikrolitrih oziroma litrov.
Formule enot kemijske koncentracije
V primeru kemijskih koncentracijskih enot se količina komponent raztopine, zlasti topljene, izraža v številu molov ali v številu ustreznikov. Te količine imajo resnično število delcev (atomi, molekule ali ioni, kot je primer).
Teh količin ni mogoče vedeti preprosto s tehtanjem ali merjenjem prostornine snovi, vendar je treba poznati sestavo ali kemijsko formulo spojin, da se določi koncentracija. To je glavni razlog, zakaj se imenujejo kemične koncentracije.
Nato so predstavljene različne formule za izračun štirih najpogosteje uporabljenih kemijskih koncentracij:
Molarnost (m)
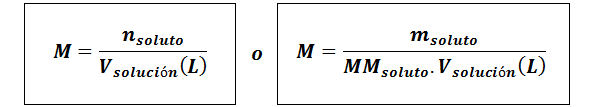
Kjetopilo So moli topljene, mtopilo predstavlja maso topljenega v gramih, mmtopilo je njegova molarna masa in vrešitev To je prostornina raztopine v litrih.
Molalnost (m)
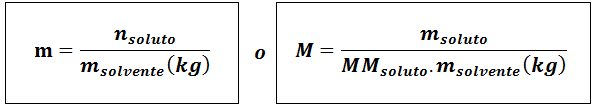
Kjetopilo So moli topljene, mtopilo predstavlja maso topljenega v gramih, mmtopilo To je njegova molarna masa in mtopilo To je masa topila v kilogramih.
Vam lahko služi: solvacijaMolarna frakcija (x)
Molarno frakcijo lahko izračunamo tako za topilo kot za topilo. Molarni delež topljenosti je:
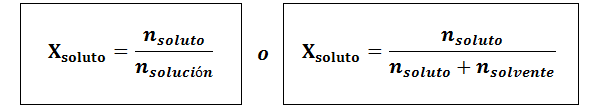
Topilo je:
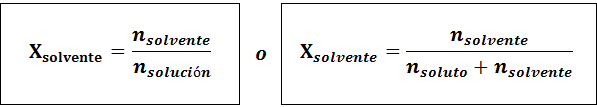
Razmerje med obema molarnima frakcijama je:
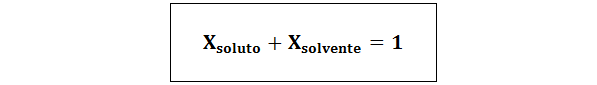
V vseh primerih ntopilo, nrešitev in ntopilo so moli topljene, raztopine in topila.
Normalnost (n)
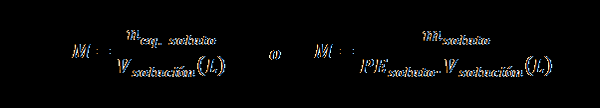
Tukaj nEq. topilo predstavlja število ekvivalenta topila, mtopilo predstavlja maso topljenega, PEtopilo Je enakovredna teža topljene in vrešitev To je prostornina raztopine v litrih.
Primeri kemične koncentracije
- Koncentracija soli v morski vodi je 35 g/L, kar ustreza molarnosti 0,60 mol/L.
- Povprečna koncentracija krvnega sladkorja je med 82 mg/dl in 110 mg/dL. Te koncentracije so enake preprostemu naslovu pri 0,82 g/L in 1,10 g/L, v molarnosti pa pri 4.4.10-3 mol/l in 6.1.10-3 Mol/L.
- Zrak se lahko šteje za plinasto raztopino, ki jo tvorijo predvsem dušik in kisik, topilo pa je dušik, saj je v večjem deležu. Ta plinska raztopina vsebuje 0,22 kisikovega in dušikovega deleža približno 0,78.
- Jeklo je zlitina med železom in ogljikom. Čeprav niso strogo raztopine, gre za homogene trdne mešanice, ki običajno vsebujejo koncentracijo ogljika v vrstnem redu 0,03% in 1,075% pri masi.
- Kljub uničujočim učinkom za okolje in za zdravje ljudi so koncentracije številnih onesnaževal običajno precej nizke. Primer je največja koncentracija arzenove strupene kovine v vodi. Svetovna zdravstvena organizacija (WHO) je ugotovila, da pitna voda ne sme vsebovati koncentracije arzena, večjo od 10ppb m/v (deli na milijardo ali nanogrami na liter). Ta koncentracija je enakovredna 0.010 ppm m/v.
Reference
- BBC (s. F.). Koncentracija raztopin - Izračuni v kemiji - AQA - GCSE Kemija (enotna znanost) Pregled - AQA. BBC Odvzet.co.Združeno kraljestvo.
- Tukaj je, kaj koncentracija pomeni v kemiji (2020). Odvzeto iz Mussionco.com.
- Librettexts (2022). 4.5: Koncentracija rešitev. Vzeti iz kem.Librettexts.org.
- Mandal, a., Md. (2021). Normalne vrednosti krvnega sladkorja. Vzeti iz novic-medical.mreža.
- Kemikalije.Neto (s. F.). Kemične koncentracije. Vzeti iz kemika.mreža.

