Značilnosti, usposabljanje, primeri
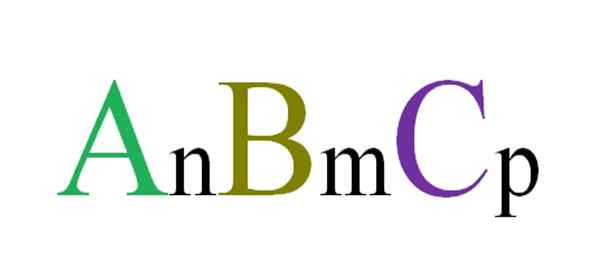
- 907
- 1
- Percy Feeney
The Ternarne spojine Vsi so tisti, ki so sestavljeni iz treh različnih atomov ali ionov. Lahko so zelo raznoliki, od kislin ali osnovnih snovi, do kovinskih zlitin, mineralov ali sodobnih materialov. Trije atomi lahko spadajo v isto skupino periodične tabele ali nadaljujejo s poljubnimi lokacijami.
Vendar pa mora biti nastala trinalna spojina, da mora obstajati kemična afiniteta med njenimi atomi. Niso vsi združljivi med seboj, zato ne morete naključno izbrati preprosto, katera bodo trije integrirali in določili spojino ali mešanico (ob predpostavki, da pomanjkanje kovalentnih vezi).
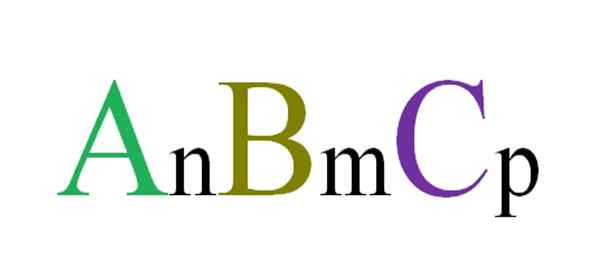 Splošna in naključna formula za trinalne spojine. Vir: Gabriel Bolívar.
Splošna in naključna formula za trinalne spojine. Vir: Gabriel Bolívar. Na primer, tri črke so naključno izbrane, ki bodo urejale Ternarno spojino ABC (vrhunska slika). Naročniki N, M in P kažejo na stehiometrične razmerja med atomi ali ioni A, B in C. Spreminjanje vrednosti takšnih naročnin in identitete črk dobimo neskončne trinalne spojine.
Vendar formula anBmCstr Velja bo le, če bo ustrezala elektroneutralnosti; to pomeni, da mora biti vsota vaših stroškov enaka nič. Glede na to obstajajo fizične (in kemične) omejitve, ki vodijo, ali je možno oblikovanje omenjene trinalne spojine.
[TOC]
Značilnosti Ternarnih spojin
Njegove značilnosti niso splošne, vendar se razlikujejo glede na kemično naravo le -teh. Na primer, oksoacidi in baze so trinalne spojine in vsaka od njih deli ali ne vrsta reprezentativnih značilnosti.
Zdaj, pred hipotetično spojino ABC, je to lahko ionsko, če razlike v elektronegativnosti med A, B in C niso velike; ali kovalentni s povezavami A-B-C. Slednje so podane v neskončnih primerih znotraj organske kemije, tako kot pri alkoholih, fenolih, etherjih, ogljikih hidratov itd., katere formule je mogoče opisati s cnHm Tudistr.
Vam lahko služi: mehanske lastnosti kovinTako so značilnosti zelo raznolike in nihajo v visoki stopnji ene tri terrinske spojine. Spojina cnHmTudistr Govori se, da je oksigeniran; medtem ko cnHmNstr, Po drugi strani je dušik (to je amin). Druge spojine so lahko žveplo, fosforirane, fluorizirane ali imajo izrazit kovinski značaj.
Baze in kisline
Napredek na področju anorganske kemije imate kovinske baze, mnTudimHstr. Daj.
Na primer, baza NAOH, ki upošteva takšne naročnine, bi morala biti napisana kot NA1Tudi1H1 (kar bi bilo kaotično). Poleg tega bi domnevali, da je h kot kation h+, In ne, kako se v resnici zdi: biti del Aniona Oh-. Zaradi dejanja OH- Na koži so te baze mili in kavstični.
Kovinske baze so ionske snovi, in čeprav so sestavljene iz dveh ionov, mn+ in oh- (Na+ in oh- Za NAOH) so tri različne atome za tri različne atome.
Kisline so na drugi strani kovalentne in njihova splošna formula je hao, kjer je običajno nemetalni atom. Vendar pa glede na enostavno ionizirano v vodi, ki sproščajo vodo, njeni H ioni+ Cvero in poškoduje kožo.
Nomenklatura
Tako kot značilnosti je tudi nomenklatura Ternarnih spojin zelo raznolika. Zaradi tega bodo površno obravnavane le baze, oksoacide in oksizale.
Baze
Kovinske baze se najprej omenjajo z besedo "hidroksid", ki ji sledi ime kovine in njena valenca v rimskih številkah v oklepajih. Tako je NaOH natrijev hidroksid (I); Ker pa natrij ima edinstveno valenco +1, ostaja preprosto kot natrijev hidroksid.
Lahko vam služi: AlceansAl (OH)3, Na primer, gre za aluminijev hidroksid (III); in Cu (OH)2, bakreni hidroksid (ii). Seveda vse v skladu s sistematično nomenklaturo.
Oksocidi
Oxóacidi imajo dokaj splošno formulo tipa HAO; Toda v resnici jih bolje opisujejo kot AOH. HA-H-jeva povezava se pojavi, da je H izdana+.
Tradicionalna nomenklatura je naslednja: začne se beseda "kislina", ki ji sledi ime osrednjega atoma, pred njo ali pred njunimi predponami (hipo, per) ali priponi (medved, ICO), glede na to, ali deluje s svojimi mladoletniki ali starejše valence.
Na primer, bromonski oksoacidi so Hbro, Hbro2, Hbro3 in hbro4. To so kisline: hipobromne, bromučne, bromurne in perbromske. Upoštevajte, da v vseh njih obstajajo trije atomi z različnimi vrednostmi za njihove naročnine.
Oksizala
Imenujejo se tudi Nullion Salts, so najbolj reprezentativne za Ternarne spojine. Edina razlika je, da jih omenimo, da se medved in ICO sufijos spreminjata za ITO oziroma ATO. H nadomestimo tudi kovinski kation, produkt nevtralizacije kisline.
Nadaljevanje z bromom bi bilo njeno natrijevo oksizalo: Nabro, Nabro2, Nabro3 in Nabro4. Njihova imena bi postala: Hipobromito, Bromito, Bromato in natrijev perbromat. Brez dvoma število možnih oksizalov presega število oksocidov.
Usposabljanje
Spet ima vsaka vrsta trinalne spojine svoj izvor ali postopek usposabljanja. Vendar je pošteno omeniti, da jih je mogoče oblikovati le, če je med člani treh atomov zadostna afiniteta. Na primer, kovinske baze obstajajo zahvaljujoč elektrostatičnim interakcijam med kationi in OH-.
Vam lahko služi: citronska kislinaNekaj podobnega se zgodi s kislinami, ki jih ni bilo mogoče oblikovati, če ni takšne kovalentne vezi a-o-h.
Na podlagi vprašanja, kako nastajajo glavne spojine? Neposredni odgovor je naslednji:
- Kovinske baze nastanejo z raztapljanjem kovinskih oksidov v vodi ali v alkalni raztopini (običajno jih zagotavljata NaOH ali amonijak).
- Oksocidi so produkt raztapljanja nemetalnih oksidov v vodi; Med njimi so2, CLO2, Ne2, SW3, Str4Tudi10, itd.
- In potem se oksizali pojavijo, ko se oksoacidi alkalizirajo ali nevtralizirajo s kovinsko podlago; Iz tega prihajajo kovinski kationi, ki podpirajo h+.
Po bolj zapletenem postopku se oblikujejo druge tri ternarne spojine, kot pri nekaterih zlitinah ali mineralih.
Primeri
Nazadnje bo kot seznam prikazana vrsta formul za različne trinalne spojine:
- MG (OH)2
- Cr (OH)3
- Kmno4
- Na3BO3
- CD (OH)2
- Starejši brat3
- Feaso4
- Bacr2Tudi7
- H2SW4
- H2Teo4
- Hcn
- AGOH
Drugi manj pogosti (in celo hipotetični) primeri so:
- Cofecu
- Algasn
- UCAPB
- Bemgo2
Naročniki N, M in P so bili izpuščeni, da ne bi zapletli formul; Čeprav v resnici njegovi stehiometrični koeficienti (razen najboljšega za bemgo2) lahko celo decimalne vrednosti.
Reference
- Shiver & Atkins. (2008). Anorganska kemija. (Četrta izdaja). MC Graw Hill.
- Whitten, Davis, Peck & Stanley. (2008). Kemija. (8. izd.). Cengage učenje.
- Gospa. Hilfstein. (s.F.). Ternarni Comununds. Okreval od: tenafly.K12.Nj.nas
- Wikipedija. (2019). Ternary Comund. Pridobljeno iz: v.Wikipedija.org
- Carmen Bello, Arantxa Isasi, Ana Puerto, Germán Tomás in Ruth Vicente. (s.F.). Ternarne spojine. Okrevano od: IESDMJAC.Educa.Aragon.je
- « Značilnosti kvartarnih spojin, usposabljanje, primeri
- Značilnosti posebnih spojin, usposabljanje, uporabe »

