Značilnosti kvartarnih spojin, usposabljanje, primeri
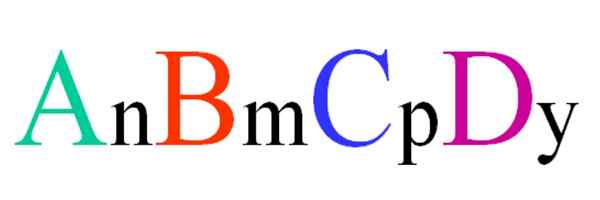
- 3327
- 85
- Barry Ernser
The Kvartarne spojine Vsi so tisti, ki imajo štiri različne atome ali ione. Zato so lahko molekularna ali ionska vrsta. Njegove raznolikosti zajemajo organsko in anorgansko kemijo, ki je zelo obsežna skupina; Čeprav morda ne toliko v primerjavi z binarnimi ali trinalnimi spojinami.
Razlog, da je vaša številka manjša, je zato, ker morajo štiri atome ali ione združene s kemičnimi afinitetami. Niso vsi elementi združljivi med seboj in še manj, če jih štejejo za kvartet; Kar naenkrat je nekaj bolj povezanih med seboj kot z drugim parom.
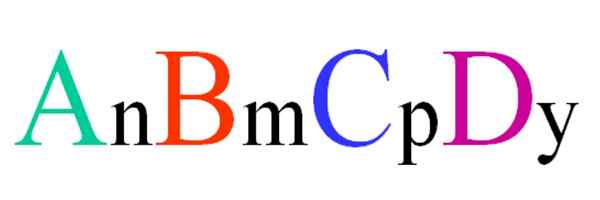 Splošna in naključna formula za kvartarno spojino. Vir: Gabriel Bolívar.
Splošna in naključna formula za kvartarno spojino. Vir: Gabriel Bolívar. Razmislite o kvartarni spojini naključne formule ABCD. Naročniki n, m, p e y so stehiometrični koeficienti, kar posledično kaže, kakšen delež vsakega atoma je v povezavi z drugimi.
Tako formula anBmCstrDin Velja bo, če bo ustrezala elektroneutralnosti. Poleg tega bo taka spojina mogoča, če bodo njihovi štirje atomi dovolj blizu drug z drugim. Videti bo, da ta formula ne velja za številne spojine, predvsem pa za zlitine ali minerale.
[TOC]
Značilnosti kvartarnih spojin
Kemikalije
Kvaternarna spojina je lahko ionska ali kovalentna, kar kaže na pričakovane značilnosti svoje narave. Pričakuje se, da bodo ABCD ionske spojine topne v vodi, alkoholih ali v drugih polarnih topilih; Morajo imeti visoke vrele in fuzijske točke in biti dobri vozniki električne energije, ko se združijo.
Kar zadeva kovalentne spojine ABCD, je večina sestavljena iz dušikovih, oksigeniranih ali halogeniranih organskih spojin; to pomeni, da bi njegova formula postala cnHmTudistrNin ali cnHmTudistrXin, X je atom halogena. Od teh molekul bi bilo logično misliti, da so polarne glede na visoke elektronegativnosti O, N in X.
Vam lahko služi: natrijev klorid (NaCl)Čisto kovalentna spojina ABCD ima lahko številne možnosti povezave: A-B, B-C, D-A itd., Odvisno od afinitet in elektronskih zmogljivosti atomov. Medtem ko so v čisto ionski spojini ABCD, so njene interakcije elektrostatične: a+B-C+D-, Na primer.
V primeru zlitine, ki se šteje za bolj trdno mešanico kot spojino pravilno, je ABCD sestavljen iz nevtralnih atomov v bazalnih stanjih (teoretično).
Ostala je spojina ABCD lahko nevtralna, kisli ali osnovna, odvisno od identitete njegovih atomov.
Fizično
Fizično gledano je verjetno, da ABCD ne postane plin, ker štirje različni atomi vedno vključujejo večjo molekulsko maso ali formulirajo. Če ne gre za tekočino z visoko vrelišče.
Spet njegove barve, vonj, tekstura, kristali itd., Zavzeli bodo, kako soobstajajo A, B, C in D v spojini, in bodo odvisni od njihove sinergije in struktur.
Nomenklatura
Do zdaj je bilo vprašanje kvartarnih spojin obravnavano na globalni in nenatančen način. Zapuščanje organske kemije na stran (amidas, benchilo kloridi, kvartarni amonijevi soli itd.), V anorganski kemiji obstajajo dobro definirani primeri, imenovani kisli in osnovni oksizali.
Kisle oksizale
Kisline oksizale so tiste, ki izhajajo iz delne nevtralizacije poliprotične oksocide. Tako se eden ali več njegovih vodikov nadomesti s kovinskimi kationi in manj ostankov vodika ima, manj kisle bo.
Na primer fosforna kislina, h3Po4, Do dve kisli soli lahko dobimo, recimo, natrij. To so: ne2Po4 (Na+ nadomesti vodik, ki ustreza H+) in na2HPO4.
Vam lahko služi: Selenium: Zgodovina, lastnosti, struktura, pridobivanje, uporabeGlede na tradicionalno nomenklaturo so te soli poimenovane kot tudi oksizale (popolnoma nezaščitene), vendar pred besedo "kislina" do imena kovine. Tako ne2Po4 To bi bil natrijev fosfat in Na2HPO4 Natrijeva kislina fosfat (ker ima h.
Po drugi strani nomenklatura zalog raje uporablja besedo "vodik", ki je "kislina". Nah2Po4 To bi bil natrijev dihidrogen in NA2HPO4 Vodikov natrijev fosfat. Upoštevajte, da imajo te soli štiri atome: na, h, p in o.
Osnovne oksizale
Osnovni oksizali so tisti, ki vsebujejo anion OH v svoji sestavi-. Na primer razmislite o solinskem kanuju3Oh (ca2+ Ne3- Oh-). Če ga poimenujemo, bi bilo dovolj, da bi besedo "osnovno" dali imenu kovine. Tako bi bilo njegovo ime: osnovni kalcijev nitrat. Kaj pa Cuio3Oh? Njegovo ime bi bilo: CuPric Basic Yodato (Cu2+ Io3- Oh-).
V skladu z nomenklaturo zalog besedo "osnovno" nadomesti hidroksid, ki ji sledi uporaba skripta pred imenom Oxoanion.
Ponavljanje prejšnjih primerov bi bila njihova imena za vsako: kalcijev hidroksid-nitrat in bakreni hidroksid-andodat (II); Če se spomnimo, da mora biti kovinska Valencia navedena v oklepajih in z rimskimi številkami.
Dvojne soli
V dvojnih soli sta dva različna kationa, ki delujeta z isto vrsto aniona. Recimo dvojna sol: cu3Vera (po4)3 (Cu2+ Vera3+ Po43-). To je železov in bakreni fosfat, vendar je najprimernejše ime za to: Triple Baker (II) in železo (III) fosfat.
Hidrirane soli
To so hidrati in edina razlika je v tem, da je na koncu njihovih imen določeno število vodnih formul. Na primer mncl2 To je mangan klorid (ii).
Vam lahko služi: benzoine: struktura, lastnosti, uporabe in tveganjaNjegov hidrat, mncl2· 4H2O Imenuje se manganov klorid (ii) tetrahidrat. Upoštevajte, da obstajajo štirje različni atomi: Mn, Cl, H in O.
Znana dvojna in hidrirana sol je Mohr, vera (NH4)2(SW4)2· 6H2Tudi. Njegovo ime je: dvojni železni sulfat (ii) in heksahidrat amonij.
Usposabljanje
Ponovno, osredotočemo na anorganske kvartarne spojine, imamo večinoma produkt delnih nevtralizacij. Če se ti pojavijo v prisotnosti več kovinskih oksidov, so verjetno dvojne soli; In če je medij zelo osnoven, se bodo osnovne oksizale oborile.
In če imajo na drugi strani molekule vode afiniteta do kovine, se bodo neposredno usklajevale z njo ali z okoliškimi ioni, ki tvorijo hidrate.
Na strani zlitin je treba za proizvodnjo kondenzatorjev, polprevodnikov ali tranzistorjev variti štiri različne kovine ali metaloide.
Primeri
Končno je spodaj prikazan seznam z različnimi primeri kvartarnih spojin. Bralec ga lahko uporabi za preizkušanje svojega znanja o nomenklaturi:
- PBCO3(OH)2
- Cr (hso4)3
- Nahco3
- Znioh
- Cu2(OH)2SW3
- Li2Kaso4
- Cuso4· 5H2Tudi
- Agau (tako4)2
- Ovitek4· 2H2Tudi
- FECL3· 6H2Tudi
Reference
- Shiver & Atkins. (2008). Anorganska kemija. (Četrta izdaja). MC Graw Hill.
- Whitten, Davis, Peck & Stanley. (2008). Kemija. (8. izd.). Cengage učenje.
- Anorganska nomenklatura in formulacija. [PDF]. Pridobljeno iz: Viri.izobrazba.je
- Erika thalîa dobro. (2019). Dvojne soli. Akademija. Okreval od: akademija.Edu
- Wikipedija. (2019). Kvartarni amonijev kation. Pridobljeno iz: v.Wikipedija.org

