Aluminijev klorid (ALCL3)

- 1812
- 364
- Lee Farrell
 Formula in struktura aluminijevega klorida
Formula in struktura aluminijevega klorida Kaj je aluminijev klorid?
On Aluminijev klorid To je anorganska kemična spojina, katere formula je alcl3. Predstavljen je kot trden ali beli prah, čeprav zaradi kontaminacije s železom kloridom in vlago lahko postane rumena. Sestavljen je iz Lewisove kisline, v določenih okoliščinah pa se obnaša tudi kot Lewisova baza.
Kljub aluminiju kot kovini v periodični mizi obstaja kovalentna vez med aluminijem in klorom, da tvori aluminijev klorid.
Ta kovalentna vez bi lahko razložila, zakaj je staljeni aluminijev klorid slab prevodnik električne energije; Medtem ko so staljene soli drugih spojin, kot je natrijev klorid, dobri električni vodniki.
Aluminijev klorid nastane z eksotermično reakcijo med aluminijem in klorom ali vodikovim kloridom pri temperaturi med 650 in 750 ° C.
Aluminijev klorid se uporablja kot protiranspirant in za boj proti prekomernemu potepu. Eden od njegovih derivatov se uporablja kot koagulantno sredstvo pri čiščenju industrijske odpadne vode in se uporablja tudi kot glavni katalizator v kemičnih reakcijah industrije.
Struktura aluminijevega klorida
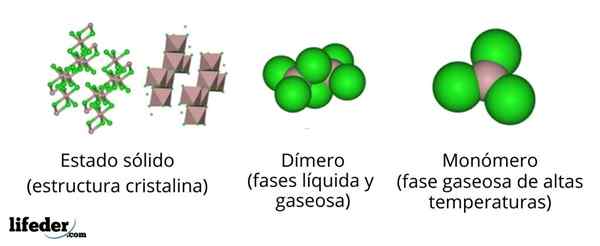
Na zgornji sliki imamo različne predstavitve za vsako kristalno ali molekulsko strukturo, ki prikazuje brezvodni aluminijev klorid, Alcl3, V več njegovih fizičnih stanjih.
Alcl3 Trdna trdnost je sestavljena iz monoklinične kristalne strukture, ki jo tvorijo plasti oktaedrov, usklajene med seboj. V teh oktaedri (rjava barva), ion do3+ Koordiniran je s šestimi CL ioni-, Igrajoči kloridi kot mostovi med dvema oktaedrima.
Ko se temperatura zviša in je ALLL ustanovljen3, Plasti so ločene na enote do2Cl6 (Slikovni center). Zdaj aluminijasta atom tvori povezave s tremi atomi klora in povezavo z drugim aluminijastim atomom: Cl3Al-alcl3. Ti dimerji pojasnjujejo, zakaj alcl3 Molten je manj gost od kristalov.
Vam lahko služi: gadolinio: struktura, lastnosti, pridobivanje, uporabeV fazi pare so dimerji2Cl6 Se oddaljujejo drug z drugim. Če pa je ta para podvržena visokim temperaturam, dimer disociira v molekularnih enotah alcl3, v katerem aluminijasti atom tvori tri povezave z atomi klora. Alcl3 predstavlja trigonalno ravno geometrijo.
Lastnosti aluminijevega klorida
 Trden vzorec aluminijevega klorida z rumenkastimi toni. Vir: xlollitox, cc do 3.0, prek Wikimedia Commons
Trden vzorec aluminijevega klorida z rumenkastimi toni. Vir: xlollitox, cc do 3.0, prek Wikimedia Commons Formule
Alcl3 (brezvodna)
Alcl3· 6H2O (heksahidrat)
Molarna masa
133.34 g/mol (anhidro)
241.43 g/mol (heksahidrat)
Fizični videz
Kristalni trden ali beli prah. Lahko postane rumenkast odtenek zaradi kontaminacije s železom kloridom. Za vlago lahko spremenite tudi sivkasto barvo.
Tališče
192.4 ° C
Vrelišče
Sublima pri 178 ° C, zato ni enostavno pridobiti vrelišča aluminijevega klorida.
Gostota
2.48 g/cm3 (brezvodna)
2.398 g/cm3 (Heksahidrat)
Topnost vode
439 G/L A 0 ° C
458 g/l pri 20 ° C
466 g/l a 30 ° C
Aluminijev klorid je higroskopska spojina, ki lahko absorbira mokro zračno vodo in med postopkom oddaja dim.
Topnost v drugih topilih
Etanol topen, kloroform, ogljikov tetraklorid, benzofenon in nitrobenzen. Rahlo topen v benzenu.
Parni tlak
13.3 kPa pri 151 ° C (0.131 ATM).
Goo
0.35 CP do 197 ° C
Reaktivnost
Aluminijev klorid je amfotatna snov, to je, da se obnaša kot kislina ali baza. Vendar je njegovo delovanje kot kislina prevladujoče, saj se aluminijev klorid uporablja kot Lewisova kislina in je hkrati katalizator v številnih kemičnih reakcijah; Med njimi je reakcija Friedel-Craftsa.
Vam lahko služi: neodimij: struktura, lastnosti, uporabeCelo aluminijev klorid je razvrščen kot kislina, namesto da bi to storil kot sol.
Brezvodni aluminijev klorid v vodni raztopini se pretvori v heksahidratno sol (ALCL3· 6H2O), ki se s segrevanjem ne vrne v brezvodno obliko.
Aluminijasti atomi dveh molekul alcl3 Med seboj sodelujejo in izpolnijo 8 elektronov v svoji valenčni plasti, kar ima za posledico nastanek dimera do2Cl6. Ta dimer je prisoten v staljenem aluminijevem kloridu in pari.
Aluminijev klorid reagira z natrijevim hidroksidom, da tvori aluminijev hidroksid, želatinozno oborino:
Alcl3 + NaOH → AL (OH)3 + 3 NaCl
Aluminijeve kloridne aplikacije
Protiranspirant in antihemoragičen
 Aluminijev klorid je del sestavin, ki se uporabljajo v formulacijah več deodorantov. Vir: Th145, cc by-sa 2.0, prek Wikimedia Commons
Aluminijev klorid je del sestavin, ki se uporabljajo v formulacijah več deodorantov. Vir: Th145, cc by-sa 2.0, prek Wikimedia Commons Aluminijev klorid se uporablja kot antitranspirant v osebnih deodorantih in se uporablja tudi za nadzor prekomernega potenja (hiperhidroza). Uporablja se tudi v formulacijah za nadzor majhnih krvavitve, kot so tiste, predstavljene v zobnih tretmajih.
Obdelava odplak
Aluminijev klorid v obliki PAC (polialumin klorid) se uporablja kot koagulant pri obdelavi industrijske odpadne vode, zaradi sposobnosti razjasnitve vode in dehidratnega blata.
Katalizator
Aluminijev klorid je eden glavnih katalizatorjev v industriji, ki deluje kot katalizator v številnih reakcijah, vključno z Friedel-Crafts.
Vam lahko služi: europium: struktura, lastnosti, pridobivanje, uporabeAluminijev klorid katalizira pripravljalne reakcije antrakinonov, od katerih se nekatere uporabljajo v tekstilni industriji. Obstajajo tudi antrakinoni, ki imajo antibakterijske, antiparazitske, fungicidne in protivirusne lastnosti.
Aluminijev klorid katalizira reakcije, ki jih proizvaja dodecilbenzen, ki se uporablja pri proizvodnji detergentov, in etilbenzena, spojine, ki se uporablja pri proizvodnji polistirena, polimera, ki se uporablja pri izdelavi plastike, smole in gume.
Aluminijev klorid se uporablja tudi kot katalizator v reakciji, ki je del proizvodnje z visoko oktansko bencin. Prav tako katalizira postopek razpokanja olja.
Tveganja
Aluminijev klorid je jedko snov, njegov stik pa lahko povzroči draženje in poškodbe kože in oči, kar povzroči poškodbe oči.
Pri raztapljanju v vodi se lahko sprostijo strupeni plini, kot je vodikov klorid; plini, ki lahko vdihavajo draženje nosu in grla, lahko povzročijo žilavo in pljučno draženje. To draženje lahko privede do kopičenja tekočine v pljučih (pljučni edem), ki se konča v medicinski nujni.
Poskušal je vzpostaviti povezavo med Alzheimerjevo boleznijo in aluminijevim kloridom; Čeprav rezultati raziskav niso dokončni.
Prav tako je bila raziskana povezava med uporabo deodorantov, ki jih uporabljajo kot anti -transpirant za ALLL3 in rak dojke. Raziskave niso mogle pokazati dokončnega odnosa. Vsekakor aluminijev klorid blokira delovanje naravnega sistema razstrupljanja organizma in toplotne emisije, kot je znoj.
Reference
- Wikipedija. (2021). Kloridni aluminij. Pridobljeno iz: v.Wikipedija.org
- Nacionalni center za informacije o biotehnologiji (2021). Kloridni aluminij, povzetek spojine Pubchem za CID 24012. Okrevano od: pubchem.NCBI.NLM.ameriški nacionalni inštitut za zdravje.Gov
- NJ zdravje. (2008). List za nevarne snovi: aluminijev klorid. [PDF]. Okreval od: NJ.Gov
- Britannica Encyclopeedia. (2021). Kloridni aluminij. Okrevano od: Britannica.com
- Elsevier b.V. (2021). Antrakinoni. Znanstveno. Pridobljeno iz: SCINCEDIRECT.com
- John P. Cunha. (02. maja 2020). Aluminij aktualnega klorida. Okreval od: rxlist.com

