Zgodovina klora, lastnosti, strukture, tveganja, uporabe

- 4471
- 1177
- Cary Goyette
On Klor Gre za kemični element, ki ga predstavlja simbol CL. Je drugi od halogenov, ki se nahaja pod fluorom, saj je tudi tretji najbolj elektronegativni element vseh. Njegovo ime izhaja iz njene rumenkasto zelene barve, ki je bolj intenzivna kot fluor.
Popularno, ko nekdo posluša njihovo ime, kar najprej misli, da je v izdelkih za beljenje za oblačila in v vodi bazenov. Čeprav klor v takšnih primerih učinkovito deluje, ni njen plin, ampak njegove spojine (zlasti hipoklorit).
 Okrogla bučka z plinastim klorom v notranjosti. Vir: Larenmclane [CC BY-SA 4.0 (https: // creativeCommons.Org/licence/by-sa/4.0)]
Okrogla bučka z plinastim klorom v notranjosti. Vir: Larenmclane [CC BY-SA 4.0 (https: // creativeCommons.Org/licence/by-sa/4.0)] Na zgornji sliki je prikazana okrogla bučka z plinastim klorom. Njegova gostota je večja kot v zraku, kar pojasnjuje, zakaj ostane v bučki in ne pobegne proti ozračju; Kot pri drugih lažjih plinih, če rečem helij ali dušik. V tem stanju je izjemno strupena snov, saj proizvaja klorovodikovo kislino v pljučih.
Zato elementarni ali plinasti klor nima preveč uporab, več kot v nekaterih sintezi. Vendar njegove spojine, ne glede na.
Tudi njeni atomi v obliki kloridnih anionov so v naših telesih, uravnavajo raven natrija, kalcija in kalija, pa tudi v želodčnem soku. Če ne, bi bil vnos natrijevega klorida še bolj smrtonosen.
Klor se pojavlja z elektrolizo slanice, bogato z natrijevim kloridom, industrijskim procesom, v katerem se pridobijo tudi natrijev in vodikov hidroksid. In ker so morja skoraj neizčrpen vir te soli, so potencialne rezerve tega elementa v hidrosferi zelo velike.
[TOC]
Zgodovina
Prvi pristopi
Zaradi visoke reaktivnosti plinastega klora starodavne civilizacije niso nikoli sumile na njihov obstoj. Vendar so bile njihove spojine del kulture človeštva iz preteklosti; Njegova zgodovina se je začela povezati s skupno soljo.
Po drugi strani je klor izhajal iz vulkanskih izbruhov in ko je nekdo raztopil zlato v kraljevski vodi; Toda noben od teh prvih pristopov ni bil dovolj, da bi oblikoval idejo, da je ta rumenkasto zeleni plin sestavljen element.
Odkritje
Odkritje klora se pripisuje švedskemu kemiku Carlu Wilhelmu Scheeleu, ki je leta 1774 opravil reakcijo med mineralno mineralno in klorovodiko v piroluzitu (do takrat imenovane muriatalna kislina).
Scheele ostaja z zaslugo, saj je bil prvi znanstvenik, ki je preučil lastnosti klora; Čeprav ga je Jan Baptist Van Helmont že prej priznal (1630).
Eksperimenti, s katerimi je Scheele pridobil svoja opažanja, so zanimivi: ocenjeval je razgradljivo delovanje klora na rdečkaste in modrikaste cvetove cvetov, pa tudi na listih rastlin in žuželk, ki so v trenutku umrle žuželke.
Prav tako je obvestil svojo visoko reaktivno do kovin, zadušljiv vonj in nezaželen učinek na pljuča in da se je, ko se je raztopila v vodi.
Oimuriatična kislina
Do takrat so kemikalije veljale za kislino za vse tiste spojine, ki je imela kisik; Tako so zgrešili klor bi moral biti plinasti oksid. Bilo je tako, da so ga poimenovali "oksijurianska kislina" (oksid muriatične kisline), ime, ki ga je skoval slavni francoski kemik Antoine Lavoisier.
Nato sta leta 1809 Joseph Louis Gay-Lussac in Louis Jacques Thénard poskušala zmanjšati to ogljikovo kislino; reakcija, pridobljena s kovinami iz njihovih oksidov. Na ta način so želeli izvleči kemični element iz domnevne oksimurične kisline (ki so jo poimenovali "defistični zrak muriatične kisline".
Vendar pa Gay-Lussac in Thénard nista uspela v njihovih poskusih; vendar so bili uspešni, če so upoštevali, da bi moral biti rumenkasto zeleni plin kemični element in ne spojina.
Prepoznavanje kot element
Prepoznavanje klora kot kemičnega elementa je bilo zahvaljujoč sir Humphryju Davyju, ki je leta 1810 opravil svoje eksperimente s premogovnimi elektrodami in ugotovil, da je res takšen oksid muriatične kisline.
Poleg tega je Davy tisti, ki je za ta element skoval ime "klor" iz grške besede "kloros", kar pomeni rumenkasto.
Ko so preučevali kemijske lastnosti klora, je bilo ugotovljeno, da imajo številne njihove spojine fiziološko naravo; Zato so ga poimenovali kot "halogen", kar pomeni oblikovalca prodaje. Nato je bil izraz halogen uporabljen z drugimi elementi iste skupine (F, BR in I).
Michael Faraday je celo uspel utekočiniti2· H2Tudi.
Vam lahko služi: učinkovita jedrska obremenitevPreostanek zgodovine klora je povezan s svojimi razkužilnimi in belilnimi lastnostmi, z razvojem industrijskega procesa slanice za proizvodnjo ogromnih količin klora.
Fizikalne in kemijske lastnosti
Fizični videz
Je neprozoren rumenkasto zeleni gost plin, razdražljiv vonj po hektarh (zelo okrepljena različica komercialnega klora) in je tudi izjemno strupena.
Atomsko število (z)
17
Atomska teža
35,45 u.
Če ni drugače navedeno, preostale lastnosti ustrezajo velikosti, merjenim za molekularni klor, CL2.
Vrelišče
-34,04 ° C
Tališče
-101,5 ° C
Gostota
-V normalnih pogojih 3,2 g/l
-Ravno na vrelišču, 1.5624 g/ml
Upoštevajte, da je tekoči klor približno petkrat več kot njegov plin. Prav tako je gostota njegove pare 2,49 -krat večja od zraka. Zato na prvi sliki klor ne pobegne iz okrogle bučke, saj je gostejši od zraka v ozadju. Ta funkcija še vedno naredi nevarnejši plin.
Fuzijska toplota
6.406 kJ/mol
Toplota za uparjanje
20,41 kJ/mol
Molarna toplotna sposobnost
33,95 j/(mol · k)
Topnost vode
1,46 g/100 ml pri 0 ° C
Parni tlak
7,67 atm pri 25 ° C. Ta tlak je v primerjavi z drugimi plini razmeroma nizek.
Elektronegativnost
3.16 na lestvici Pauling.
Ionizacijske energije
-Prvi: 1251.2 kJ/mol
-Drugi: 2298 kJ/mol
-Tretjič: 3822 kJ/mol
Toplotna prevodnost
8.9 · 10-3 W/(m · k)
Izotopi
Klor se v naravi pojavlja predvsem kot dva izotopa: 35Cl, z obilico 76%in 37CL, z obilico 24%. Tako je atomska teža (35,45 U) povprečje atomskih mas teh dveh izotopov z njihovimi odstotki številčnosti.
Vsi klor radioizotopi so umetni, med katerimi 36CL kot najbolj stabilen, s pol življenja 300.000 let.
Oksidacijske številke
Klor ima lahko več številk ali oksidacijskih stanj, kadar je del spojine. Ker je eden najbolj elektronegativnih atomov v periodični tabeli, ima običajno negativne oksidacijske številke; Razen kadar teče s kisikom ali fluorom, v katerih oksidi in fluoridi mora "izgubiti" elektrone.
V njegovih oksidacijskih številkah se predpostavlja obstoj ali prisotnost ionov z enako velikostjo obremenitve. Tako imamo: -1 (cl-, Znani kloridni anion), +1 (Cl+), +2 (Cl2+), +3 (Cl3+), +4 (Cl4+), +5 (Cl5+), +6 (Cl6+) in +7 (Cl7+). Od tega so -1, +1, +3, +5 in +7 najpogostejši v kloriranih spojinah.
Za primere v CLF in CLF3 Številke oksidacije za klor so +1 (Cl+F-) in +3 (Cl3+F3-). V CL2Ali pa je to +1 (Cl2+Tudi2-); medtem ko v CLO2, Cl2Tudi3 in Cl2Tudi7, Sin +4 (Cl4+Tudi22-), +3 (Cl23+Tudi32-) in +7 (Cl27+Tudi72-).
V vseh kloridih ima klor oksidacijsko število -1; kot v primeru NaCl (NA+Cl-), Kjer je veljavno reči, da CL obstaja- Glede na ionsko naravo te soli.
Elektronska struktura in konfiguracija
Molekula klora
 Diatomska molekula klora, predstavljena z modelom vesoljskega polnjenja. Vir: Benjah-BMM27 prek Wikipedije.
Diatomska molekula klora, predstavljena z modelom vesoljskega polnjenja. Vir: Benjah-BMM27 prek Wikipedije. Atomi klora v svojem bazalnem stanju imajo naslednjo elektronsko konfiguracijo:
[NE] 3S2 3P5
Zato ima vsak od njih sedem elektronov Valencije. Če niso preobremenjeni z energijo, bodo v prostoru na voljo posamezni atomi, kot da bi bili zeleni marmorji. Vendar je njegova naravna nagnjenost k oblikovanju kovalentnih vezi med njimi, da bi dokončali svoje oktete Valencije.
Upoštevajte, da komaj potrebujejo elektron, da imajo osem valenčnih elektronov, zato tvorijo eno preprosto povezavo; To je tisti, ki se pridruži dva atoma CL, da ustvari molekulo CL2 (Zgornja slika), CL-CL. Zato je klor v normalnih in/ali kopenskih pogojih molekularni plin; Nemonoatomski, kot je to pri plemenitih plinih.
Medmolekularne interakcije
Molekula Cl2 Je homonuklearna in apolarna, zato njene medmolekularne interakcije urejajo disperzijske sile Londona in njegove molekularne mase. V fazi sode je razdalja Cl2-Cl2 V primerjavi z drugimi plini je razmeroma kratek, ki je, dodal svojo maso, plin trikrat več kot zrak.
Svetloba lahko vzbudi in spodbuja elektronske prehode znotraj molekulskih orbitalov CL2; Posledično se pojavi njegova značilna rumenkasto zelena barva. Ta barva se okrepi v tekočem stanju in nato delno izgine, ko se strdi.
Vam lahko služi: šibke bazeKo se temperatura spušča (-34 ° C), molekule CL2 Izgubijo kinetično energijo in razdaljo Cl2-Cl2 zmanjšanje; Zato so kohezivne in na koncu definirajo tekoči klor. Enako se zgodi, ko se sistem (-101 ° C) še naprej ohladi, zdaj z molekulami CL2 Torej skupaj, ki definira Ortorrombic kristal.
Dejstvo, da obstajajo kristali klora, kaže, da so njihove disperzivne sile dovolj usmerjene, da ustvarijo strukturni vzorec; To je, molekularne plasti Cl2. Ločitev teh plasti je takšna, da je tudi pod pritiskom 64 GPa njegova struktura spremenjena, niti ne kažejo električnega prevoda.
Kje je in dobimo
Kloridne soli
 Robustni kristali Halitine, bolj znane kot običajna ali namizna sol. Vir: starš Géry [cc by-sa 3.0 (https: // creativeCommons.Org/licence/by-sa/3.0)]
Robustni kristali Halitine, bolj znane kot običajna ali namizna sol. Vir: starš Géry [cc by-sa 3.0 (https: // creativeCommons.Org/licence/by-sa/3.0)] Klor v plinastem stanju ni mogoče najti nikjer na površini zemlje, saj je zelo reaktiven in nagiba k kloridi. Ti kloridi so dobro razširjeni po Zemljini skorji, poleg tega pa po milijonih let vlečejo deževje, morja in oceani obogatijo.
Med vsemi kloridi je najpogostejša in obilna mineralna minerala naCl Del Mineral Halita (nadrejena podoba); Sledijo Silvina, KCL in Carnalita, MGCL Minerals2· KCL · 6H2Tudi. Ko vodne mase izhlapijo s sončnim delovanjem, za seboj pustijo puščavska solna jezera, iz katerih lahko NaCl ekstrahiramo neposredno kot surovino za klor.
Slanica elektroliza
NaCl se raztopi v vodi, da nastane slanica (26%), na katero je elektroliza podvržena v kloralkalinsko celico. V predelkih anode in katoda se odvijata dve pol -reakciji:
2Cl-(Ac) => cl2(g) + 2e- (Anoda)
2H2Ali (l) + 2e- => 2OH-(Ac) + h2(g) (katoda)
In globalna enačba za obe reakciji je:
2nacl (AC) + 2H2Ali (l) => 2naOH (AC) + H2(g) + cl2(g)
Ko poteka reakcija, Na ioni+ Oblikovani na anodi se selijo v katodni predal, ki prečka prepustno azbestno membrano. Zaradi tega je NAOH na desni strani globalne enačbe. Oba plina, CL2 in h2, Zbrani so iz anode in katode.
Spodnja slika ponazarja novo napisano:
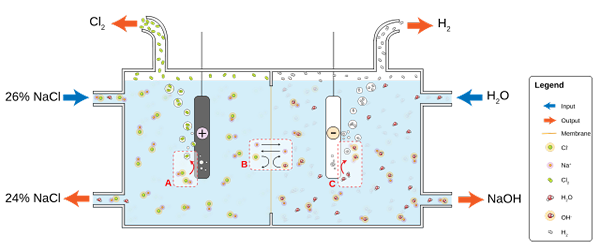 Diagram za proizvodnjo klora s pomočjo elektrolize slanice. Vir: jkwchui [cc by-sa 3.0 (https: // creativeCommons.Org/licence/by-sa/3.0)]
Diagram za proizvodnjo klora s pomočjo elektrolize slanice. Vir: jkwchui [cc by-sa 3.0 (https: // creativeCommons.Org/licence/by-sa/3.0)] Upoštevajte, da se koncentracija slanice na koncu zmanjša za 2% (gre od 24 do 26%), kar pomeni, da del njegovega CL- Originali so se spremenili v molekule CL2. Na koncu je industrializacija tega procesa omogočila način proizvodnje klora, vodika in natrijevega hidroksida.
Kislo raztapljanje piroluzita
Kot je omenjeno v razdelku Zgodovina, se plinasti klor lahko ustvari z raztapljanjem vzorcev piroluzitne rude s klorovodikovo kislino. Naslednja kemična enačba prikazuje produkte, dobljene iz reakcije:
Mne2(s) + 4HCl (AC) => mcl2(AC) + 2H2Ali (l) + cl2(g)
Zlitine
Iz dveh preprostih razlogov ni zlitin klora: njihovih plinastih molekul ni mogoče ujeti med kovinske kristale, prav tako pa so zelo reaktivne, zato bi takoj reagirali s kovinami, da bi ustvarili svoj klorid.
Po drugi strani tudi kloridi niso zaželeni, ker ko se enkrat raztopijo v vodi, izvajajo slani učinek, ki spodbuja korozijo v zlitinah; In zato se kovine raztopijo, da tvorijo kovinske kloride. Proces korozije za vsako zlitino je drugačen; Nekateri so bolj dovzetni kot drugi.
Klor posledično sploh ni dober dodatek za zlitine; niti kot Cl2 niti kot Cl- (In atomi bi bili zelo reaktivni, da bi lahko sploh obstajali).
Tveganja
Čeprav je topnost klora v vodi nizka, je dovolj, da v vlaži naše kože in oči proizvajajo klorovodikovo kislino.
Še huje je, da vdihnejo njihove rumenkaste zelenkaste hlape, saj enkrat v pljučih spet ustvari kisline in poškoduje pljučno tkivo. S tem oseba doživlja bolečine v grlu, kašelj in težave z dihanjem zaradi tekočin, ki nastanejo v pljučih.
Če pride do pobega klora, se sooča s posebno nevarno situacijo: zrak ne more preprosto "pometati" svojih hlapov; ostanite tam, dokler se ne odzovejo ali se počasi razpršijo.
Vam lahko služi: natančno ravnovesje: značilnosti, funkcije, deli, uporabePoleg tega gre za zelo oksidacijsko spojino, zato lahko več snovi z njim eksplozivno reagira na najmanjši stik; Kot pri jekleni volni in aluminiju. Zato je treba sprejeti vse potrebne pomisleke, če obstaja shranjeni klor, da se prepreči požarna tveganja.
Ironično je, da je plinasti klor smrtonosen, njegov kloridni anion ni strupen; Lahko ga zaužijemo (zmerno), ne gori ali reagira, razen s fluoridom in drugimi reagenti.
Prijave
Sinteza
Približno 81 % plinastega klora, ki se proizvede letno, je namenjeno sintezi organskih in anorganskih kloridov. Glede na stopnjo kovalentnosti teh spojin je klor mogoče najti kot zgolj atomi CL v kloriranih organskih molekulah (z C-CL vezi) ali kot CL ions- V nekaj kloridnih soli (NaCl, cacl2, MGCL2, itd.).
Vsaka od teh spojin ima svoje aplikacije. Na primer kloroform (chcl3) in etil klorid (ch3Pogl2Cl) so topila, ki se uporabljajo kot inhalacijsko anestetiko; Diklorometano (ch2Cl2) in ogljikov tetraklorid (CCl4), Saj se topila pogosto uporablja v laboratorijih za organsko kemijo.
Ko so te klorirane spojine tekoče, so večino časa namenjene topilom za organske reakcije.
V drugih spojinah prisotnost atomov klora predstavlja povečanje v dipolnem trenutku, zato lahko v večji meri medsebojno komunicirajo s polarno matrico; a tvorijo beljakovine, aminokisline, nukleinske kisline itd., biomolekule. Tako ima klor tudi papir v sintezi zdravil, pesticidov, insekticidov, fungicidov itd.
Kar zadeva anorganske kloride, se običajno uporabljajo kot katalizatorji, surovine za pridobivanje kovin z elektrolizo ali viri CL ionov-.
Biološko
Plinasti ali elementarni klor nima nobene vloge v živih bitjih več kot uničenje njihovih tkiv. Vendar to ne pomeni, da njihovih atomov ni mogoče najti v telesu. Na primer, Cl ioni- V celičnem in zunajceličnem mediju so zelo obilne in pomagajo nadzorovati ravni Na ionov+ in ca2+, večinoma.
Prav tako je klorovodikova kislina del želodčnega soka, s katerim se hrana prebavi v želodcu; njegovi ioni-, V družbi H3Tudi+, Določite pH blizu 1 od teh izločkov.
Kemično orožje
Gostota plinastega klora je smrtna snov, ko se razlije ali vlije v zaprte ali odprte prostore. Ker je gostejši od zraka, tok tega ne zlahka vleče klora, zato ostane precej časa, preden se končno razprši.
Na primer v prvi svetovni vojni je bil ta klor uporabljen na bojnih poljih. Ko je bil izpuščen, se je prikradel v jarke, da bi zadušil vojake in jih prisilil, naj gredo na površje.
Razkužilo
 Bazeni so kloronizirani, da se izognejo razmnoževanju in širjenju mikroorganizmov. Vir: Pixabay.
Bazeni so kloronizirani, da se izognejo razmnoževanju in širjenju mikroorganizmov. Vir: Pixabay. Kloronizirane raztopine, tiste, pri katerih je bil plinasti klor raztopljen v vodi in nato alkaliziran s pufrom, imajo odlične razkužilne lastnosti in zavirajo gnilobo tkiv. Uporabljali so jih za razkuževanje odprtih ran za odpravo patogenih bakterij.
Voda bazena je natančno kloronizirana za odpravo bakterij, mikrobov in zajedavcev, ki jih lahko hranijo. V ta namen se je nekoč uporabljal plinasti klor, vendar je njegovo delovanje precej agresivno. Namesto tega se uporabljajo raztopine natrijevega hipoklorita (belilo) ali trikloroizocianurne kisline (ATC) (ATC).
Zgornje kaže, da to ni CL2 Tisti, ki izvaja delovanje razkužila, razen HClo, hipokloritne kisline, ki proizvaja radikale ali ·, ki uničuje mikroorganizme.
Belilo
Klor zelo podobno kot razkužitveni akciji, tudi materiale beli, ker so barve, odgovorne za HClo. Tako so njegove kloronizirane rešitve idealne za odstranjevanje lis iz belih oblačil ali za beljenje papirnate kaše.
Polivinilklorid
Najpomembnejša klorirana spojina vseh, za katere je dodeljena približno 19% preostale proizvodnje plinastega klora, je vinil poliklorid (PVC). Ta plastika ima več načinov. Z njo so narejene vodne cevi, okni, okna, stene sten in tal, električno ožičenje, intravenske vrečke, plašče itd.
Reference
- Shiver & Atkins. (2008). Anorganska kemija. (Četrta izdaja). MC Graw Hill.
- Wikipedija. (2019). Klor. Pridobljeno iz: v.Wikipedija.org
- Laura h. et al. (2018). Struktura trdnega klora pri 1.45 gpazeitschrift für KristallGraphie. Kristalni materiali, zvezek 234, številka 4, strani 277-280, ISSN (na spletu) 2196-7105, ISSN (tisk) 2194-4946, doi: doi.org/10.1515/Zkr-2018-2145
- Nacionalni center za informacije o biotehnologiji. (2019). Klor. Baza podatkov Pubchem. Cid = 24526. Okrevano od: pubchem.NCBI.NLM.ameriški nacionalni inštitut za zdravje.Gov
- Marques Miguel. (s.F.). Klor. Okreval od: Nautilus.Fis.UC.Pt
- Ameriški svet za kemijo. (2019). Kemija klora: Uvod v klor. Okrevano od: klor.Americachemistry.com
- Fong-yan ma. (s.F.). Jedki učinki kloridov na kovine. Oddelek za pomorsko inženirstvo, Kitajska republika Ntou (Tajvan).
- New York State. (2019). Dejstva o kloru. Okrevano od: zdravje.Ny.Gov
- Doktor. Doug Stewart. (2019). Dejstva o klorovih elementih. Kemikool. Okrevano od: Chemicool.com

