Struktura natrijevega klorita (NACLO2), lastnosti, uporabe, tveganja

- 4863
- 26
- Cary Goyette
On Natrijev klorit Gre za anorgansko trdno snov, ki jo tvori ionski natrij NA+ in ionski klorit2-. Njegova kemična formula je NACLO2. Je kristalno bela trdna snov, poleg tega, da je močno oksidacijsko sredstvo. Zato mora biti zelo previden.
Njegova glavna uporaba je kot agent za razkužilo za številne aplikacije. Omogoča odpravljanje mikrobov na površinah, kot so tla, stene in laboratorijska oprema v bolnišnicah in klinikah ter v njihovih vodnih sistemih.
 Natrijev klorit naclo2 trden. Avtor: Chemical Interest . Vir: Wikimedia Commons.
Natrijev klorit naclo2 trden. Avtor: Chemical Interest . Vir: Wikimedia Commons. Tudi v kmetijskih in veterinarskih ustanovah, higienizaciji inkubatorjev ptičjih jajc, za nadzor okužb krav molznic, razkuževanje vodnih sistemov za živali itd.
V prehrambeni industriji njihove nakit.
Z natrijevim kloritom lahko pripravimo klor dioksid2 Na mestu uporabe, ki vam omogoča odstranjevanje mikrobov, slabih vonjav in okusov vode, tako da je prijetno in lahko pijete brez težav.
Služi tudi za beljenje papirnate kaše, zelenjavna tekstilna vlakna in olja, med drugimi aplikacijami.
Naclo2 Trdno je treba ravnati previdno, ker lahko pride do stika z določenimi materiali. Njihove rešitve je nekoliko lažje manipulirati, vendar so zelo oksidacijske in korozivne.
[TOC]
Struktura
Natrijev klorit je sestavljen iz natrijevega na kationa+ in anionski klorit2- Zato jih združuje ionska vez.
Kloritni anion ima atom klora v stanju oksidacije +3 in dva atoma kisika z Valencijo -2. Zaradi tega ima kloritni anion negativno breme.
Ima tudi strukturo v obliki kota.
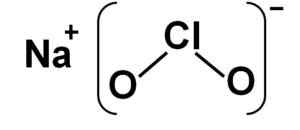 Naclo natrijeva kloritna struktura2. Avtor: Marilú Stea.
Naclo natrijeva kloritna struktura2. Avtor: Marilú Stea. Nomenklatura
- Natrijev klorit
- Natrijev klorit
- Natrijeva sol kloro
Lastnosti
Fizično stanje
Kristalno bela trdna trdna snov.
Molekularna teža
90,44 g/mol.
Tališče
Razpade, ko se topi med 180 in 200 ° C.
Gostota
2.468 g/cm3
Topnost
Voda topna: 64 g/100 g vode pri 17 ° C. Rahlo topen v metanolu.
Druge lastnosti
Je rahlo higroskopsko.
Je močno oksidacijsko sredstvo. Silovito reagira z gorljivimi materiali in reduktorji. Silovito reagira s kislinami in ustvarja klor dioksid2.
Vam lahko služi: pravila Hume-rotheryNjegove alkalne raztopine (pomeni v prisotnosti na primer NaOH) so precej stabilne, v kislem mediju2, ki hitro razpade:
4 Hclo2 → 2 CLO2↑ + clo3- + Cl- + 2 h+ + H2Tudi
Tveganja
Oba Naclo2 trdne, saj so njihove vodne rešitve potencialno nevarne in zahtevajo veliko previdnosti in izkušenj med njihovo manipulacijo in skladiščenjem.
Naclo2 Trdna lahko eksplodira, ko pridete v stik z organskimi snovmi, vključno z rokavicami in oblačili, materiali za krčenje, kot sta žaga in odpadni bombaž, ter olja in maščobe.
Trdna oblika je zato zelo težko prevažati in jo je raje uporabljati v obliki vodnih raztopin.
Te rešitve so izjemno korozivne. Prednostno bi morali hraniti pH nad 8, to je alkalni pH.
Naclo2 pospeši zgorevanje spojin ali vnetljivih materialov do te mere, da lahko s temi tvori eksplozivne mešanice.
Če se segreje, oddajte strupene kadilce klorovodikove kisline HCl in natrijevega oksida NA2Tudi. Če je podaljšana za toploto ali ogenj, lahko izkorišča.
Pridobivanje
Pripravljen je začenši s kemičnim ali elektrokemičnim zmanjšanjem Sodio NaClo3, V prisotnosti klorovodikove kisline HCl za proizvodnjo klora dioksida2.
Slednje reagira z vodikovim peroksidom H2Tudi2 V vodni raztopini NaOH natrijevega hidroksida in natrijevega natrijevega klorita dobimo2, ki izhlapi in kristalizira trdno snov.
Dobimo ga lahko tudi s prehodom plina s klorovim dioksidom2 Za raztopino NAOH.
2 clo2 + 2 NaOH → NACLO2 + Naclo3 + H2Tudi
Prijave
Kot mikrobicid in razkužilo v več aplikacijah
Je sestavina številnih izdelkov, ki služijo za nadzor bakterij, gliv in blata ali alg blata. Izdelki, ki ga vsebujejo v ta namen, se uporabljajo v kmetijstvu, trgovini, industriji in rezidencah ali domovih.
Služi kot razkužila številnih vrst materialov in površin.
V kmetijstvu so perutnina in podobne panoge razkužene trde površine, oprema, zmogljivosti za inkubacijo ptičjih jajc, rastlinjake za glive, kot so gobe, in hladilne vodne in vodne vode za peresa ptic.
Veterinarsko uporabo ima kot aktualno razkužilo pri nadzoru mastitisa mleka, da potopi bradavičke živali. Mastitis je okužba krav UDERS.
Vam lahko služi: adiabatski postopek: vrste, primeri, rešene vaje Včasih morate krave potopiti v raztopine natrijevega klorita, da se izognete okužbam v njih. Avtor: Hans Braxmeier. Vir: Pixabay.
Včasih morate krave potopiti v raztopine natrijevega klorita, da se izognete okužbam v njih. Avtor: Hans Braxmeier. Vir: Pixabay. Uporablja se tudi v naravnih raziskovalnih ustanovah za dekontaminiranje laboratorijev.
Komercialne, industrijske in medicinske uporabe vključujejo razkuževanje prezračevalnih sistemov, trde površine (kot so tla, stene, laboratorijska oprema) in vodni sistemi.
V zdravstvenih ustanovah, kot so klinike in bolnišnice.
Uporabno je tudi za higienizacijo v obratih, kjer ljudje podvržejo zdravstveni načini vode ali zdravilišč.
V živilski industriji se uporablja kot fumigant za ohranjanje hrane.
Uporablja se v obliki zakisanega natrijevega klorita. To nastane z dodajanjem kisline s hrano (na primer citronsko kislino, fosforno kislino, kolesne kisline ali natrijeve kisline) v vodno raztopino natrijevega klorita.
Zakisani natrijev klorit ima protimikrobne lastnosti in se uporablja kot rosa ali piščančja pranje ali namakalno raztopino, meso, zelenjavo, sadje in morske izdelke. Tudi v vodi za zamrznitev piščanca ali ptic.
V gospodinjstvih omogoča razkuževanje trdih površin, kot so tla in kopalnice, sistemi za ogrevanje ali klimatsko napravo in sistemi za kroženje vode v bazenu.
 Če želite razkužiti bazene, lahko uporabite natrijev klorit naclo2. Avtor: Age Global Group. Vir: Pixabay.
Če želite razkužiti bazene, lahko uporabite natrijev klorit naclo2. Avtor: Age Global Group. Vir: Pixabay.  Izdelki, ki vsebujejo natrijev klorit, omogočajo toaletne kopalnice. Avtor: Michal Jarmoluk. Vir: Pixabay.
Izdelki, ki vsebujejo natrijev klorit, omogočajo toaletne kopalnice. Avtor: Michal Jarmoluk. Vir: Pixabay. Prodaja se tudi v majhnih vrečkah, skupaj z drugimi spojinami za sproščanje plina in nadzor vonja v domovih.
Razkužiti pitno vodo
Uporablja se pri čiščenju vode za pijačo, deluje kot oksidant, izboljšuje okus in vonj po pitni vodi.
Natrijev klorit se široko uporablja kot predhodnik za nastajanje CLO klora dioksida2 ki služi za zdravljenje pitne vode za prehrano ljudi, to je za odpravo mikroorganizmov, vonjav in neprijetnih okusov ter lahko pije.
Za ustvarjanje CLO2 HCl se lahko uporablja:
5 Naclo2 + 4 HCl → 4 CLO2↑ + 5 NaCl + 2 h2Tudi
CLO2 Je protimikrobno sredstvo z visoko akcijskim oksidantom in širokim spektrom. To pomeni, da deluje proti velikemu številu mikroorganizmov.
Lahko vam služi: kalijev nitrit (KNO2): struktura, lastnosti in uporabeMikroorganizmi so deaktivirani, ker CLO2 posega v pomembne encime teh in s celičnimi membranskimi beljakovinami. Prednost ima tudi, da ne proizvaja organoklonskih spojin, ki so strupene.
Na voljo so natrijeve kloritne tablete, pomešane z drugimi spojinami, ki se raztopijo v vodi in takoj proizvedejo CLO2 na nadzorovan način, s čimer razkužete vodo.
 Natrijev klorit se uporablja z drugimi spojinami za pridobivanje pitne vode, pripravljene za pitje. Avtor: Ulrike Leone. Vir: Pixabay.
Natrijev klorit se uporablja z drugimi spojinami za pridobivanje pitne vode, pripravljene za pitje. Avtor: Ulrike Leone. Vir: Pixabay. Glavni problem čiščenja vode za odstranjevanje okusov in vonj skozi CLO2 Sestavljen je v tem, da lahko med zdravljenjem tvorimo strupene kloritne in klorirne soli.
Za nego kontaktnih leč
Naclo2 Je sestavni del rešitev, ki se uporabljajo za razkuževanje kontaktnih leč.
Uporablja se kombinacija NACLO2 in sledi (zelo majhne količine) vodikovega peroksida H2Tudi2.
H2Tudi2 Stabilizirajte CLO2 To je oblikovano in kombinacija obeh je zelo učinkovita proti bakterijam, glivam in kvasovkam. Izdelki, ki so takrat, so natrijev klorid, voda in kisik, ki so neškodljivi, kar pomeni, da niso škodljivi za oko.
Ko se leče odstranijo iz raztopine, NaClo2 Preostali se hitro razpade v nallu in o2. Preostali peroksid ne draži oko. Zato so te rešitve zelo varne.
 Raztopine za razkuževanje kontaktnih leč imajo med sestavinami natrijev klorit. Avtor: nieuw ~ commonswiki. Vir: Wikimedia Commons.
Raztopine za razkuževanje kontaktnih leč imajo med sestavinami natrijev klorit. Avtor: nieuw ~ commonswiki. Vir: Wikimedia Commons. V različnih aplikacijah
Natrijev klorit se uporablja za pripravo klora dioksida2 za takojšnjo uporabo v velikem številu aplikacij, od katerih so bile nekatere obravnavane v prejšnjih odstavkih.
Služi za beljenje lesene celuloze, tekstila, kot so bombaž, rastlinska vlakna, užitna in nežitna olja, maščobe, laki, laki in voski.
Je sestavni del očesnih kapljic in nekaj rešitev za ustno pranje.
Uporablja se v industriji obdelave usnja in v agentih za kovinsko elektrodo (kovinska prevleka).
Reference
- Williams, l. et al. (2019). Mikrobiologija, oskrba in vzdrževanje leč. V kontaktnih lečah (šesta izdaja). Okrevano od Scientirect.com.
- Ali.S. Nacionalna knjižnica medicine. (2019). Natrijev klorit. Okrevano od PubChema.NCBI.NLM.ameriški nacionalni inštitut za zdravje.Gov.
- Siva, n.F. (2014). Klorin dioksid. Procesna tehnologija. V mikrobiologiji vodnih bolezni (druga izdaja). Okrevano od Scientirect.com.
- McKen, l. (2012). Uvod v prehrano in medicinsko sterilizacijo. Klorin dioksid. V učinek sterilizacije na plastiko in elastomere (tretja izdaja). Okrevano od Scientirect.com.
- Ortenberg, npr. in Telsch, b. (2003). Težave z okusom in vonjem v pitni vodi. V priročniku mikrobiologije vode in odpadne vode. Okrevano od Scientirect.com.
- Karsa, d.R. (2007). Biocidi. Klorin dioksid. V priročniku za čiščenje/dekontaminacijo površin. Okrevano od Scientirect.com.
- Bombaž, f. Albert in Wilkinson, Geoffrey. (1980). Napredna anorganska kemija. Četrta izdaja. John Wiley & Sons.
- Ullmannova enciklopedija industrijske kemije. (1990). Peta izdaja. VCH Verlagsgellschaft MBH.

