Kinetični encim
- 1355
- 147
- Cary Goyette
Kaj je encimska kinetika?
The Kinetični encim Gre za študijsko področje, na katerem se fizikalnokemija in biokemija srečujeta za preučevanje kemijskih reakcij, ki jih katalizirajo encimi. Encimi so biološki katalizatorji, ki povečujejo hitrost kemične reakcije z zmanjšanjem energije aktivacije.
Encimi katalizirajo kemijske reakcije, ki so zelo pomembni za vzdrževanje življenja. Imajo pH in optimalno temperaturo, da izvajajo svoje katalitično delovanje na podlagi, zato so bistveni dejavniki pri preučevanju njihovih dejavnosti.
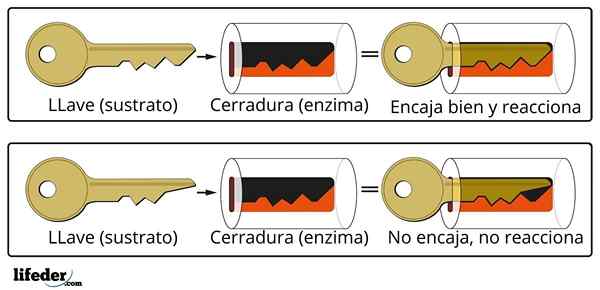
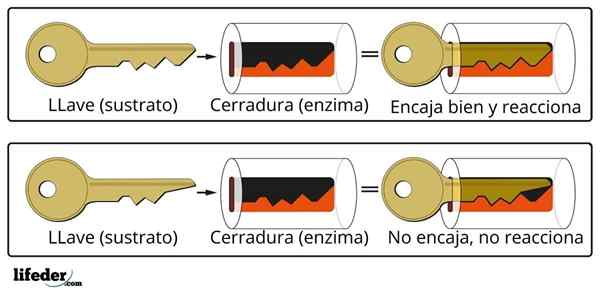 Sistem za zapiranje ključa je približna analogija sistemu substrata-encime.
Sistem za zapiranje ključa je približna analogija sistemu substrata-encime. Encim sodeluje s substratom skozi specializirano območje svoje beljakovinske verige, ki se imenuje aktivno središče, katerega tridimenzionalna struktura je povezana s strukturo substrata. Interakcija med aktivnim centrom in substratom je običajno šibka in ni kovalentna.
Število aktivnih encimskih centrov je omejeno, kar povzroči nasičenost z molekulami substrata, kar posledično preprečuje, da bi se hitrost reakcije povečala nad določeno vrednostjo, znana kot največja hitrost.
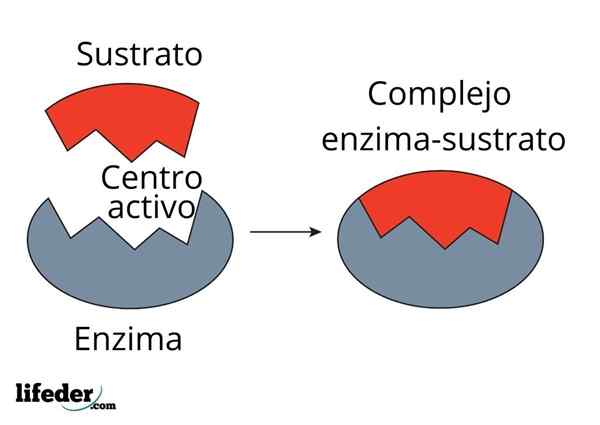
Encimska kinetika ne združuje le biokemije in fizikokemije, temveč tudi bioinorgansko, supramolekularno kemijo, računalniško kemijo in statistiko.
Med modeli, ki ga opisujejo, je Michaelis -Menc. Danes je še vedno eden izmed modelov, ki se najbolj uporablja za opis encimske kinetike.
Osnovni koncepti v encimski kinetiki
Encimska kataliza
Encimi so beljakovine, s katalitičnimi aktivnostmi, ki lahko delujejo na molekulo, imenovano substrat, in katalizirajo njegovo transformacijo v drugo snov, znano kot izdelek. Encimi se med katalitičnim delovanjem ne porabijo, kar ostane stalna masa.
Katalitična aktivnost
Katalitična aktivnost encima se izvaja v specializirani tridimenzionalni strukturi, znani kot aktivni center. To tvori pregib encimske beljakovinske verige, ki določa interakcijo skupine aminokislin, ki tvorijo aktivno središče.
Aktivni center
Aktivni center ni toga struktura, ampak se lahko geometrijsko prilagaja substratu za interakcijo z njim. Interakcija je na splošno šibka (sile van der Waals), čeprav obstajajo encimi, ki tvorijo kovalentno povezavo s substratom.
Vam lahko služi: maščoba maščobe: pridobivanje, vrste, sestava, uporabe, koristiZmanjšana aktivacijska energija
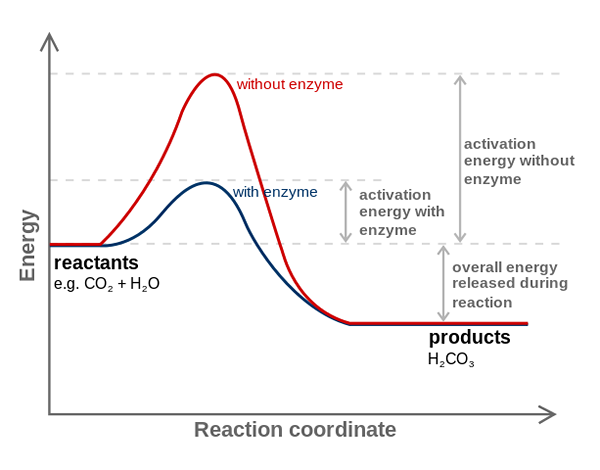 Encim ogljikove anhidraze zmanjšuje aktivacijsko energijo za pretvorbo CO2 do H2CO3. Vir: fvasconcellos (pogovor • prispevki), cc by-sa 3.0, prek Wikimedia Commons
Encim ogljikove anhidraze zmanjšuje aktivacijsko energijo za pretvorbo CO2 do H2CO3. Vir: fvasconcellos (pogovor • prispevki), cc by-sa 3.0, prek Wikimedia Commons Encimi katalizirajo reakcije, ki zmanjšujejo aktivacijsko energijo in zato zmanjšujejo tudi prosto porabo energije (g), potrebno za dokončanje kataliziranega procesa. Encimi ne spreminjajo ravnotežne točke nekataliziranih kemičnih reakcij.
Upoštevajte, kako encim ogljikove anhidraze zmanjšuje aktivacijsko energijo za co -konverzijo2 do h2Co3. Čeprav se razdalja med rdečo in modrikovo črto ne zdi veliko, ta encim poveča hitrost v vrstnem redu milijonovkrat (106) v primerjavi z reakcijo brez njihove udeležbe.
Stereoespecifičnost
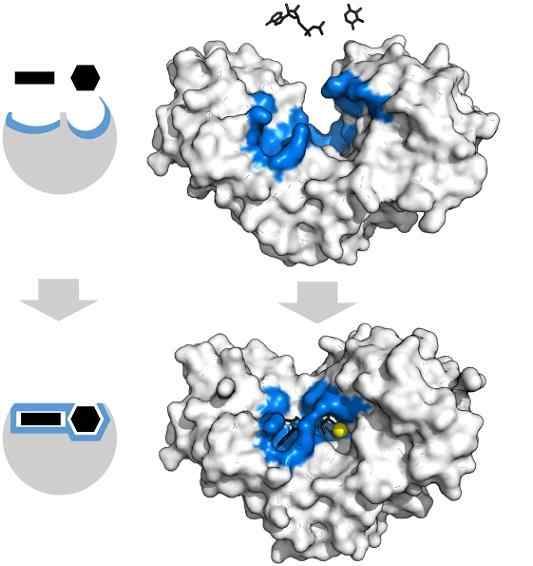 Adenozin substrati trifosfat in ksiloza imata specifično obliko, ki sovpada z geometrijo aktivnega središča encima heksokinaze. Vir: Thomas Shafee, CC do 4.0, prek Wikimedia Commons
Adenozin substrati trifosfat in ksiloza imata specifično obliko, ki sovpada z geometrijo aktivnega središča encima heksokinaze. Vir: Thomas Shafee, CC do 4.0, prek Wikimedia Commons Encimi so na splošno zelo specifični za reakcije, ki jih katalizirajo, saj morajo molekule substrata v interakciji z aktivnim centrom, ki predstavlja niz zahtev za njihovo povezavo z njim.
Tako na primer aktivno središče heksokinaze, ki je dinamično zaradi molekulskih vibracij beljakovinskih verig, ponuja skupine v natančnih prostorskih orientacijah, tako da molekule adenozin in ksiloze adenozin lime.
Najmanjše fizične ali kemične motnje in regija modra -heksokinaze ne more več namestiti podlage.
Največja hitrost
Encimi imajo omejeno število aktivnih centrov, zato s povečanjem koncentracije substrata. To določa, da se hitrost katalizirane reakcije ne more povečati nad določeno vrednostjo, znano kot največja hitrost.
Občutljivost za temperaturo in pH
Encimska katalitična aktivnost je odvisna od temperature in pH, saj ima optimalne vrednosti teh parametrov za njegovo delovanje. Prav tako, ker gre za molekule beljakovin encimov, so dovzetne za kemično ali toplotno denaturacijo.
Kofaktorji
Nekateri encimi povečajo svojo katalitično aktivnost zaradi vpliva nekaterih dejavnikov, ki so lahko kovine ali organske spojine, znane kot koencimi.
Prav tako lahko encime zaviramo konkurenčno in nekonkurenčno. V primeru heksokinaze od zgoraj MG2+ (rumena krogla) deluje kot kofaktor.
Encimska hitrost reakcije
Hitrost encimske reakcije je odvisna od koncentracije substrata in encimske koncentracije. Kadar je koncentracija substrata nizka, obstaja skoraj linearno razmerje med encimsko hitrostjo in koncentracijo substrata.
Lahko vam služi: brez kovin: zgodovina, lastnosti, skupine, uporabeZato se encimska hitrost povečuje v neposrednem sorazmerju s koncentracijo substrata; Toda s povečanjem koncentracije substrata na vrednost, ki nasiči aktivna mesta encima.
Ko se encimska hitrost pojavi, postane konstantna, to je neodvisna od koncentracije podlage in pravijo, da je encimska hitrost nič. Poleg tega je katalitična encimska hitrost sorazmerna s koncentracijo encimskega substratnega kompleksa [IS].
Kot kaže matematični izraz:
V = k2[Je]
Največja hitrost je neposredno sorazmerna s skupno koncentracijo encima, kot se pojavlja v naslednji formuli:
VMax = KMačkaInt
KMačka To je vrtena ali nadomestna številka in predstavlja število molekul substrata, ki jih vsako encimsko mesto pretvori v izdelek na enoto časa. Medtemt predstavlja število katalitičnih encimskih mest. DAt Ima visoko vrednost, višja [s] je potrebna za nasičenje aktivnih mest ali centrov.
Michaelis -Mente Enačba
Model
Model Mihaelis -MENTE temelji na delovanju encimov, ki delujejo na preprost podlagi in ni uporabna za alosterične encime; torej tisti, ki imajo regulativno območje katalitične aktivnosti aktivnega mesta.
Encimi pri nizki koncentraciji substrata imajo katalitično aktivnost, ki je linearna s koncentracijo substrata; Toda pri visokih koncentracijah substrata je katalitična aktivnost neodvisna od koncentracije substrata.
Leta 1913 sta Leonor Michelis in Maud Minded predlagala model za razlago navedenega encimskega vedenja, obstoja vmesnega kompleksa encim-sustrato [je] pomemben v modelu [IS].
Splošna enačba
Odnos tega kompleksa z drugimi sestavnimi deli encimskega procesa in s konstantami (k), ki jih povezujejo, so navedeni v naslednji shemi:
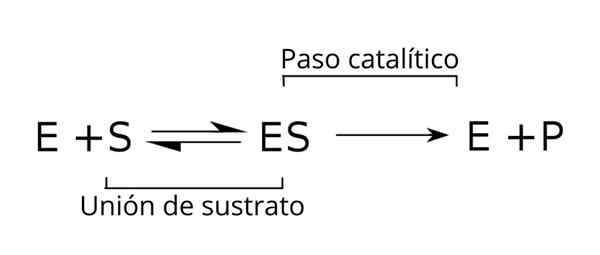 Splošna enačba substratov, encimskega kompleksa in produktov encimske kinetike. Vir: Tim Vickers prek Wikipedije.
Splošna enačba substratov, encimskega kompleksa in produktov encimske kinetike. Vir: Tim Vickers prek Wikipedije. Encim (E) je kombiniran s substratom (S), da tvori encimsko-substratni kompleks s konstanto K-hitrosti1. Kompleks E-S lahko disociira v E in S s konstanto reakcijske hitrosti k-1.
Prav tako lahko kompleks povzroči izdelek (P) in ločitev encima, ki ga je mogoče reciklirati, da doseže drug cikel encimske aktivnosti. Za državo je mogoče doseči ravnotežje [IS], v kateri je njegova hitrost tvorbe enaka njeni hitrosti razgradnje.
Lahko vam služi: naravni kemični elementiK1[Je] [s] = (k-1 + K2) [IS] (1)
Previdnost izrazov in čiščenje [IS], imate:
[Je] = ([e] [s]) / (k-1 + K2 / K1) (2)
KM = (K-1 + K2) / K1
KM To je stalnica, ki jo uvede Michaelis.
Pogoji enačbe Michaelis -mE
Zamenjava zdaj kM V (2) nadaljujemo:
[Je] = [e] [s] / kM (3)
Koncentracija encima, ki ni kombiniran, je:
[E] = [eT] - [es] (4)
Kjer je [e] prosti encim in [eT] Skupna koncentracija encima.
Združitev enačb 3 in 4, pri čemer je treba nadomestiti in upoštevati tudi VMax, Enačba Michaelis-Muene je dosežena, izražena na naslednji način:
V = (vMax [S]) / ([s] + kM)
Največja hitrost encimske reakcije se pojavi, kadar je koncentracija substrata veliko večja od KM In katalitična mesta encimov so nasičena s substratom. To se zgodi, ko razmerje [s]/[s] + kM Pristopi do 1.
Ko je [s] enak kM, Del enačbe [s] / [s] + kM je enak 1/2, kar kaže, da je kM Koncentracija substrata povzroči encimsko reakcijsko hitrost, ki je polovica največje hitrosti.
Poleg tega kM To je merilo afinitete encima s substratom: večja je vrednost KM, Minor bo afiniteta encima za substrat in obratno. Zato do a kM visoka hitrost encimske reakcije bo nizka.
Graf Lineweaver-Burk
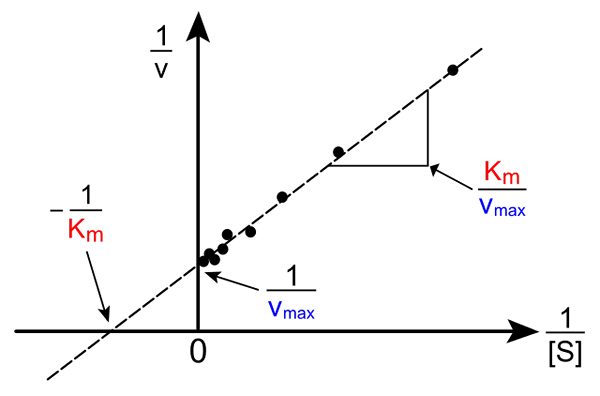 Lineweaver-burk naravnost. Vir: Pro lovilec napak prek Wikipedije.
Lineweaver-burk naravnost. Vir: Pro lovilec napak prek Wikipedije. Preoblikovanje enačbe Michaelis-Muene za izdelavo obratne oblike ima naslednjo obliko:
1/v = (kM / VMax) (1 / [s]) + 1 / vMax
Pomen te črte je, da ima križišče z osi x v - 1/kM, in z osi y pri y = 1/vMax (Zgornja slika). Linija ima naklon KM/Vmax. To omogoča informacije o VMax in kM Graficiranje inverznih hitrosti, odvisno od obratne koncentracije substrata.
Reference
- Strayer, l. (1975). Biokemija. 2daje Izdaja. Uredništvo se je vrtelo.
- Iran. Levine. (2009). Načela fizikalnokemije. Šesta izdaja. MC Graw Hill.
- Wikipedija. (2020). Encimska kinetika. Pridobljeno iz: v.Wikipedija.org
- Michael Blaber. (5. junij 2019). Encimska kinetika. Biologija librettexts. Okrevano od: Bio.Librettexts.org
- Uredniki Enyclopeedia Britannica. (2020). Kinetika Michaelis-Muen. Okrevano od: Britannica.com
- Berg JM, Tymoczko JL, Stryer L. Biokemija. 5. izdaja. New York: W H Freeman; (2002). Oddelek 8.4: Michaelis-model predstavlja kinetične lastnosti številnih encimov. Okreval od: NCBI.NLM.ameriški nacionalni inštitut za zdravje.Gov

