Kislinske razlike in baze, značilnosti, primeri
- 1533
- 276
- Miguel Gutmann DVM
The kisline in baze Gre za kemične spojine, ki ne predstavljajo niti ene opredelitve, ampak nekaj, ki so odvisne od značilnosti ali lastnosti. Na splošno bi lahko rekli, da so kisline kisle snovi, medtem ko so baze saponáceas ali mila.
Najpomembnejše definicije, kot sta Brönsted Lowry ali Arrhenius, se bolj osredotočajo na sproščanje H ionov3Tudi+ (Hydronium) u Oh-(hidroksil) s temi snovmi. Bodisi v čistih ali raztopljenih oblikah v vodi.
Opredelitev, ki nastane kot posledica zgoraj navedenega, je naslednja: kisline, raztopljene v vodi, ustvarijo raztopine z vrednostmi pH, manjše od 7, medtem ko raztopljene baze proizvajajo raztopine z vrednostmi pH, večje od 7. PH je natančno način, kako izraziti, kako kisla ali osnovna je tekočina, ki upošteva koncentracijo H3Tudi+.
Zato imajo kisle snovi, kot je pomarančni sok, pH manj kot 7 in veliko H ionov3Tudi+. Medtem ko imajo baze, kot je legía, pH večji od 7 in veliko OH ionov-.
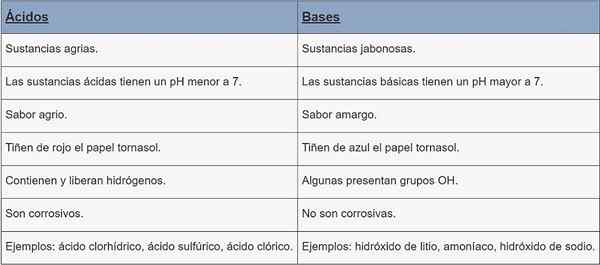
Kisline | Baze | |
Vrsta snovi | Agrarne snovi. | Snovi Jabonesas. |
ph | pH manj kot 7. | pH večji od 7. |
Okus | Kislo. | Grenka. |
Obarvanje | Rdeči papir. | CornStasol papirnato barvilo modro. |
Značilnosti | Vsebujejo in sproščajo vodike. | Nekatere prisotne OH skupine. |
Korozija | So jedke. | Niso jedki. |
Primeri | Klorovodikova kislina, žveplova kislina, klorinska kislina. | Litijev hidroksid, amonijak, natrijev hidroksid. |
Kisline
 Pomarančni sok je eden najbolj znanih kislinskih predstavnikov našega vsakdanjega življenja
Pomarančni sok je eden najbolj znanih kislinskih predstavnikov našega vsakdanjega življenja Kislinske značilnosti
Kisle snovi imajo določene značilnosti:
Kislo okus
Kisline imajo kisli okus. Redno je vrsta okusa označena z izrazom "kislina". Tako se reče, da sta limonin sok in tekočina nekaterih dlesni kislina, saj so njegovi okusi kisli in močni za nepce.
Rdeči papir
Kisline so snovi, ki lahko barvo modrega v rdečo razpršijo obrnejo. ShortAsol je del nabora snovi, ki lahko spremenijo barvo, odvisno od stopnje kislosti ali bazičnosti okolja, v katerem jih najdemo. Te snovi se imenujejo pH kazalniki.
Vam lahko služi: koligativne lastnosti rešitevVsebujejo in sproščajo vodike
Kisline so kemične spojine, ki imajo kemični element vodika (H), kar ji daje značilnost kislosti.
Številne druge snovi vsebujejo tudi vodik, vendar ga ne morejo sprostiti, kot se zgodi s kislinami. Pri osvobajanju je vodik v obliki iona ali Ckacije+. Ti h+, Ko se srečujejo z molekulami vode, jih dodajo, da tvorijo H ione3Tudi+.
Prenašajo električni tok
Zaradi H atomov+ ki se sprostijo, ko se kisline v vodi raztopijo, te lahko prenašajo elektriko z uporabo baterij ali baterij.
So jedke
Obstajajo močne kisline, ki so zelo korozivne. Zato se je treba izogibati stiku z njimi, saj lahko povzročijo hudo telesno škodo. Celo šibke kisline, pri zelo visokih koncentracijah, kot je ocet (kis).
Močna in šibka
Močne kisline proizvajajo veliko koncentracijo H ionov3Tudi+ Ko se raztopijo v vodi. Govori se, da se vodikovi atomi močnih kislin zlahka disociirajo. Medtem šibke kisline sproščajo malo vodikovih atomov in zato proizvajajo nižjo koncentracijo H ionov3Tudi+.
Močne kisline imajo zelo nizek pH, kar je odvisno od koncentracije in sile kisline, lahko je 1 ali manj. Namesto tega imajo šibke kisline višji kisli pH, ki je lahko na primer 4 ali 5.
Močne kisline imajo vonj, ki povzroča pekoč občutek. Medtem šibke kisline ne predstavljajo tega vonja, tudi v nekaterih primerih imajo prijetne vonjave. Vendar pa obstaja veliko izjem, zato jim ni priporočljivo vonjati niti šibke kisline.
Vam lahko služi: železov oksid (iii): struktura, nomenklatura, lastnosti, uporabeMočne kisline so dobri prevozniki električne energije. Nasprotno, šibke kisline so slabi prevodniki električne energije z sproščanjem nekaj a atomov+.
Močne kisline lahko napadejo kovine, kot je cink, ki tvorijo veliko število vodikovih mehurčkov. Te reakcije ne proizvajajo šibke kisline.
Primeri kislin
Močne kisline
-HCl: klorovodikova kislina
-H2SW4: žveplova kislina
-HBR: Bromhidrična kislina
-Živjo: jodhidric kislina
-Hno3: dušikova kislina
-Hclo4: perklorna kislina
-Hclo3: Klorova kislina
Šibke kisline
-Pogl3COOH: ocetna kislina
-Hno2: Dušikova kislina
-H2Co3: Ogljikova kislina
-H3Po4: fosforna kislina
-C3H5O (cooh): citronska kislina
-HF: fluorhidrična kislina
-H2SW3: Žveplova kislina
Baze
 Amoniak je osnovna snov
Amoniak je osnovna snov Osnovne značilnosti
Baze predstavljajo naslednje značilnosti:
-V prstih proizvajajo viskozen ali milni občutek, zaradi česar bodo predmeti vzeli roke, da postanejo spolzki.
-Imajo grenki okus.
-Lahko reagirajo s kislinami in proizvajajo tvorbo spojin, imenovanih soli. V nekaterih primerih lahko ti oborijo ali potopijo v vodo. Tudi v reakciji baze s kislino nastane voda.
-Obrnijo barvo modrega kalčkov papirja, kar kaže, da ima raztopina pH večji od 7 ali alkalina.
-Nekatere baze, ki so prisotne v njihovih skupinah za kemijsko formulo OH, imenovane Hydroxilli, ki jih tvorita vodikov atom in atom kisika.
Močna in šibka
Močne baze so kemijske spojine, ki predstavljajo eno ali več skupin OH v svoji kemijski strukturi, ki, ko pridejo v stik z vodo, pridobijo negativno obremenitev, OH-.
Medtem šibke podlage niso v svojih skupinah za kemijske formule hidroksilov. Vendar šibke podlage pri reakciji z vodo proizvajajo tudi ione ali anione OH-.
Močne baze, kot je natrijev hidroksid, imajo zelo visoke pH vrednosti, blizu 14. Medtem imajo šibke baze nižji pH, kot je amoniak, ki ima pH 11.
Vam lahko služi: vrelo: koncept, vrste in primeriMočne podlage se uporabljajo v domovih za odkrivanje odtokov. Takšen je primer kalijevega hidroksida. Medtem se pri čiščenju uporabljajo šibke podlage, kot je amonijak, prisoten v številnih čistilih.
Primeri baz
Močne baze
-Lioh: litijev hidroksid
-Naoh: natrijev hidroksid
-Koh: kalijev hidroksid
-RBOH: Rubidio hidroksid
-CSOH: Cezijev hidroksid
-Sr (oh)2: Stroncijev hidroksid
-Ba (oh)2: barijev hidroksid
Šibke podlage
-Nh3: amoniak
-Nhet2: dietilamin
-Nh2Pogl3: Metilamin
-C5H5N: Piridin
Razlike med kislinami in bazami
Ioni, ki se sproščajo
Kisline sproščajo h atomi+ ali h3Tudi+ Ko se raztopijo v vodi. Medtem se baze sproščajo ali proizvajajo v stiku z vodnimi ioni OH-.
PH vrednosti
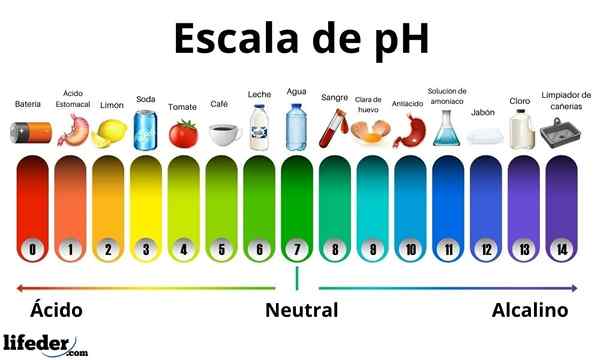
Kisline imajo pH vrednost med 0 in 7. Medtem imajo baze pH vrednost med 7 in 14. Zato kisline obrnejo barvo poganjškega papirja in baze jo obrnejo v modro.
Reakcije treninga
Kisline izvirajo iz reakcije oksidov, ki niso metalni elementi, na primer klor, žveplo itd., Z vodo, ali pa se tvorijo tudi, ko je vodik kombiniran z nemetalnim elementom in nato se oblikovana spojina raztopi v vodi (HF, HCl, HBR itd.).
Osnove nastanejo z oksidno reakcijo kovine, na primer železo, baker, magnezij itd., Z vodo. Ne pozabite, da je oksid kombinacija kisikovih atomov s katerim koli drugim kemičnim elementom.
Reference
- Whitten, Davis, Peck & Stanley. (2008). Kemija. (8. izd.). Cengage učenje.
- Čelada, Anne Marie, ph.D. (11. februar 2020). Kislinska definicija in primer. Okreval od: Thoughtco.com
- Znanstveni raziskovalci. (31. julij 2018). Poučevanje otrok o kislinah in bazah. Okrevano od: Science Explorers.com
- Pripravljanje vzorcev. (2013). Kislinske značilnosti. Okrevano od: zglednega.com
- Lumen kemija za ne-major. (s.F.). Lastnosti kislin in baz. Obnovi se od: tečajev.Lumenarning.com
- Clark Jim. (2013). Močne in šibke podlage. Okrevano od: Chemguide.co.Združeno kraljestvo
- « Flora in favna reprezentativne vrste Ekvadorske Sierre
- Metodološki okvir, kako ga napisati, struktura, primeri »

