Žveplova kislina
- 3152
- 229
- Barry Ernser
 Žveplova kislina je mineralna kislina, ki se pojavi, ko se žveplov dioksid raztopi v vodi
Žveplova kislina je mineralna kislina, ki se pojavi, ko se žveplov dioksid raztopi v vodi Kaj je žveplova kislina?
On Žveplova kislina To je oxácido, ki se tvori, ko je žveplo dioksid, torej2, se raztopi v vodi. Gre za šibko in nestabilno anorgansko kislino, ki je ni mogoče zaznati v raztopini, saj je reakcija njene tvorbe reverzibilna in kislina hitro razpade v reagentih, ki so jo proizvajali (tako2 in h₂o).
Je brezbarvna tekočina, z močnim vonjem po žveplom, nestabilni in se uporablja na različnih industrijskih poljih, kot so obarvani s klorom, za sintezo zdravilnih in kemičnih izdelkov, za proizvodnjo papirja ali za izboljšanje derivatov nafte nafte.
Molekula žveplove kisline trenutno je bila odkrita le v plinski fazi. Konjugirane baze te kisline so pogosti anioni pod oblikami sulfitov in bisulfita.
Ramanov spekter So rešitev2 Kaže le znake zaradi SO molekule2 in bisulfitni ion, hso3-, skladno z naslednjim ravnovesjem:
SW2 + H₂o hso3- + H+
To kaže, da s Ramanovim spektrom ni mogoče.
Ko je izpostavljena atmosferi, se hitro pretvori v žveplovo kislino. Žveplova kislina se zaradi delovanja razredčene žveplove kisline in cinka zmanjša na vodikov sulfid.
Poskus koncentriranja SO raztopine2 Z izhlapevanjem vode za pridobivanje žveplove kisline brez vode ni dal rezultata, saj kislina hitro razpade (investiranja reakcije na tvorbo), zato kisline ni mogoče izolirati.
Struktura Žveplova kislina
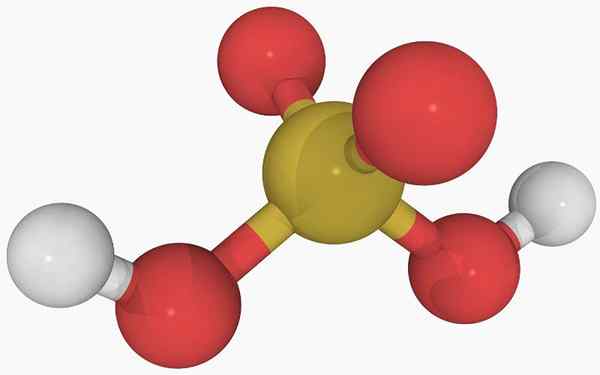
 Kemična struktura žveplove kisline
Kemična struktura žveplove kisline Na glavni sliki je mogoče videti strukturo izolirane molekule žveplove kisline v plinastem stanju. Rumena krogla v sredini ustreza atomu žvepla, rdečim atomom kisika in bela do vodikov.
Vam lahko služi: diastreomeriNjegova molekularna geometrija okoli a atoma je trigonalna piramida, z atomi ali risanje baze.
Nato v plinastem stanju molekule H2SW3 Lahko jih obravnavamo kot mikroskopske trigonalne piramide, ki plavajo v zraku, ob predpostavki, da so dovolj stabilne, da trajajo nekaj časa, ne da bi reagirali.
Struktura jasno pove, od kod dva kisla hidrogena: iz hidroksilnih skupin, povezanih z žveplom, Ho-OH-OH. Zato za to spojino ni pravilno domnevati, da je eden od kislinskih protonov, h+, se sprosti iz atoma žvepla, h-so2(OH).
Dve OH skupini omogočata, da žveplova kislina medsebojno deluje z vodikovimi mostovi in tudi kisik vezi s = o je sprejemnik vodika, zaradi česar je H2SW3 tako v dobrem darovalcu in sprejemniku teh mostov.
Glede na zgoraj navedeno h2SW3 Moral bi biti sposoben kondenzirati v tekočini, kot to počne žveplova kislina, h2SW4. Kljub temu pa se to ne zgodi.
Fizikalne in kemijske lastnosti Žveplova kislina
Molekularna formula
H2SW3
Molekularna teža
82.073 g/mol.
Fizični videz
Je brezbarvna tekočina, z začinjenim vonjem z žveplom.
Gostota
1.03 g/ml.
Gostota pare
2.3 (glede na zrak, vzet kot 1)
Jedkost
Jed je za kovine in tkiva.
Topnost vode
Merljiv.
Občutljivost
Je občutljiv na zrak.
Stabilnost
Stabilen, vendar nezdružljiv z močnimi osnovami.
Kislost konstanta (KA)
1.54 x 10-2
PKA
1.81
ph
1.5 na lestvici pH.
točka vžiga
Ni vnetljivo.
Razgradnja
Ko se segreva, lahko žveplovo kislino razgradimo, kar oddaja strupeni dim žveplovega oksida.
Vam lahko služi: kromijev hidroksid: struktura, lastnosti, sinteza, uporabaNomenklatura
Žveplo ima naslednje valence: ± 2, +4 in +6. Iz formule H2SW3, Izračunamo lahko, katera valenčna ali oksidacijska številka ima žveplo v spojini. Če želite to narediti, je dovolj za reševanje algebrske vsote:
2 (+1) + 1V + 3 (-2) = 0
Ker gre za nevtralno spojino, mora biti vsota obremenitev atomov, ki jo predstavljajo 0. Čiščenje V Za prejšnjo enačbo imate:
V = (6-2)/1
Tako je v enak +4. To pomeni, da Sulfur sodeluje s svojo drugo Valencijo, po tradicionalni nomenklaturi. Iz tega razloga za h2SW3 Znan je kot žveplova kislinamedved.
Še en hitrejši način za določitev te Valencije je primerjava h2SW3 s h2SW4.
V h2SW4 Žveplo ima Valencia +6, tako da če se ena ali, Valencia spusti na +4, in če se odstrani še ena, se Valencia spusti na +2 (kar bi bilo za kislino kolcanjeŽveplomedved, H2SW2).
Čeprav manj znan, h2SW3 V skladu z nomenklaturo ga lahko imenujemo tudi trioksosulfurinska kislina (IV).
Nastajanje žveplove kisline v naravi
Žveplova kislina nastane v naravi zaradi kombinacije žveplovega dioksida, produkta aktivnosti velikih tovarn, z atmosfersko vodo.
Zaradi tega velja za vmesni produkt kislega dežja, ki povzroča veliko škodo kmetijstvu in okolju.
Sinteza
Tehnično gledano se tvori žveplo, ki tvori žveplov dioksid. Nato se raztopi v vodi, da tvori žveplovo kislino. Vendar je reakcija reverzibilna in kislina se hitro pokvari v reaktantih.
To je razlaga, zakaj žveplove kisline ne najdemo v vodni raztopini (kot je že omenjeno v delu njegove kemijske strukture).
Vam lahko postreže: Zakon o pivuPrijave
Na splošno se uporaba in uporaba žveplove kisline, ker njene prisotnosti ni mogoče zaznati, nanašajo na uporabo in uporabo žveplovih dioksidov ter osnovo in soli kisline.
V lesu
V procesu sulfita se pojavi lesena kaša v obliki skoraj čistih celuloznih vlaken. Za ekstrakcijo lignina iz lesenih drobtin se uporablja več soli žveplove kisline z uporabo visokotlačnih posod, imenovanih Digesters.
Dezinfekcijsko sredstvo
Žveplova kislina se uporablja kot razkužilo.
Belilo
Uporablja se tudi kot mehko beljenje, zlasti za materiale, občutljivi na klor. Poleg tega se uporablja kot zobni belilnik in aditiv za hrano.
Kozmetika
Je sestavina različnih kozmetike za nego kože in je bila uporabljena kot pesticid element pri izločanju podgan. Odpravlja madeže, ki jih povzroča vino ali sadje na različnih tkaninah.
Antiseptik
Služi kot antiseptik, saj je učinkovit, da se izognete kožnim okužbam. V nekaterih trenutkih so ga uporabljali pri zamrzovanju za razkuževanje ladij, stvari žrtev epidemij itd.
Konzervans agent
Žveplova kislina se uporablja kot konzervans sadja in zelenjave ter da se izogne fermentaciji pijač, kot sta vino in pivo, ki je antioksidant, antibakterijski in glivicidni element.
Kemični izdelki
Žveplova kislina se uporablja pri sintezi zdravil in kemikalij, pri izdelavi vina in piva, v izpopolnjevanju oljnih izdelkov in kot analitični reagent.
Reference
- Nomenklatura kislin. Okreval od 2.Kemija.Gatech.Edu
- Calvo Flores, F. G. Formulacija anorganske kemije. Ugr okreval.je

