Struktura sulfáminske kisline, lastnosti, sinteza, uporablja
- 1946
- 69
- Ricky Dach
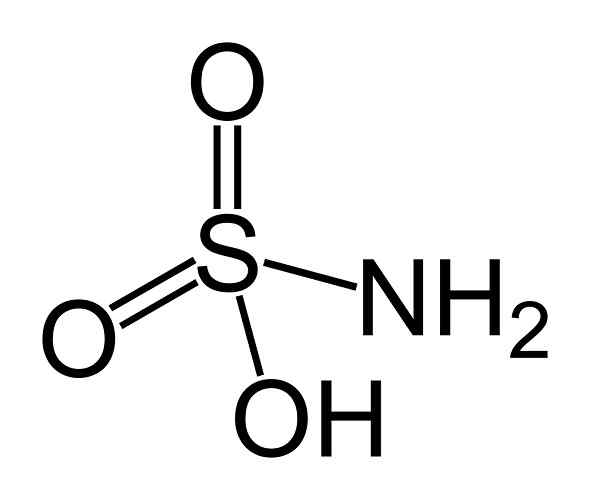
On sulfamična kislina To je anorganska spojina, ki jo tvori atom žvepla (s), pritrjenega v kovalentni obliki, in preprosta povezava do hidroksilne skupine (-OH) in amino skupino (-NH2) in z dvojno vezjo na dva atoma kisika (O). Je bela kristalna trdna. Njegova kemična formula je NH2SW3H. Znan je tudi kot aminosulfonska kislina, amidosulfonska kislina, amidosulfurinska kislina in sulfamidna kislina.
Sulfáminska kislina je močna kislina. Lahko reagirate s kovinami, kovinskimi in karbonatnimi oksidi. Soli so na splošno topne v vodi, zato je dober odstranjevalec vložkov v procesni opremi. Pogosto se uporablja v mlinih sladkorja za čiščenje karbonatnih vložkov v uparjalnikih.
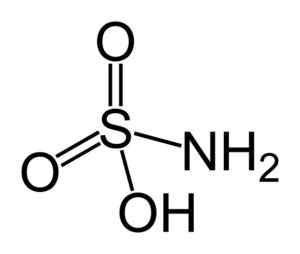 Struktura žvelene kisline. Benjah-BMM27 [javna domena]. Vir: Wikipedia Commons.
Struktura žvelene kisline. Benjah-BMM27 [javna domena]. Vir: Wikipedia Commons. Sulfámska kislina je reduktor nitritov (ne2-) in ta kemična lastnost se uporablja v več aplikacijah, kot v analizi industrije barvil in nitritov.
Uporablja se v usnjenem stroju in pri beljenju kaše za proizvodnjo papirja. Pravzaprav gre za onesnaževalec hrane, saj jo pogosto najdemo v dokumentih in karticah, ki se uporabljajo za pakiranje trgovin z živili.
Uporablja se tudi v kovinski elektrodi, kot laboratorijski vzorec in eden od njegovih derivatov je zelo učinkovit herbicid.
[TOC]
Struktura
Sulfamična kislina kristalizira v obliki bipiramidalnih kristalov OrtorRombus. Tvorijo kompaktne prizme in liste, ko kristalizirajo iz hladne raztopine, pa tudi rhombusove liste, ko je vroča vodna raztopina.
Nomenklatura
- Sulfamična kislina
- Aminosulfonska kislina
- Amidosulfonska kislina
- Amidosulfurinska kislina
- Sulfami -cid
Lastnosti
Fizično stanje
Bela kristalna trdna.
Molekularna teža
97,1 g/mol.
Tališče
205 ° C, razpade pri 209 ° C.
Gostota
2,15 g/cm3
Topnost
Topno v vodi:
- 12,8% do 0 ° C
- 17,57% pri 20 ° C
- 22,77% pri 40 ° C
Komaj topno v metanolu, rahlo topno v acetonu, netopno v etru.
Prosto topno v dušikovih bazah in organskih topilih, ki vsebujejo dušik.
Netopen v ogljikovem disulfidu (CS2) in ogljikov tetraklorid (CCl4).
ph
0,41 (v raztopini 1 n, torej 1 ekvivalent/l).
Konstanta disociacije
0,101 do 25 ° C.
Kemične lastnosti
Je močna kislina. Skoraj toliko kot klorovodikove kisline (HCl), dušikove3) in žveplovo (h2SW4).
Vam lahko služi: oksigenirane spojine: lastnosti, reakcije, uporabeVodne raztopine sulfamične kisline so zelo ionizirane. Njegov pH je nižji od raztopin formalne, fosforne in oksalne kisline.
V vodi sulfamična kislina izgubi samo proton, ki je vezan na kisik. Vodilni vodik -vkopini ostanejo trdno združeni.
V vodni raztopini se počasi hidrolizira, da daje amonijevo kislinsko sulfat (NH4HSo4). Je stabilen v suhih pogojih.
Sulfámska kislina napade kovine, kovinske okside in karbonate, da ustvari sulfamate. Na primer, s kalijevim kovinskim (k) kalijevim sulfamatom (koso2Nh2) in vodik (h2).
Vse soli sulfamične kisline so topne v vodi. Kalcij, svinčeve in barijeve soli so zelo topne v vodi, za razliko od ustrezne žveplove kisline.
Dušikova kislina (hno2) kvantitativno reagirate z amino skupino sulfamične kisline in sproščate dušik (n2). Ocenjuje se, da sulfamatni ion v tej reakciji deluje kot amida, ne kot amin.
Sulfámsko kislino oksidiramo s klorom, bromom ali kalijevim kloratom, da jo pretvori v žveplovo kislino. Ta reakcija se ne pojavi pri drugih oksidantih, kot sta kromova kislina ali kalijev permanganat.
Ni združljiv (reagiran) z močnimi alkaliji, klorom, hipoklorozno kislino, hipokloriti, cianidi in sulfidi.
Druge lastnosti
Ni higroskopska (to pomeni, da ne absorbira vlage zraka).
Ko se segreje, dokler se razgradnja oddaja zelo strupene hlape žveplovih oksidov in vodikovega klorida (HCl).
Eden od njegovih derivatov, amonijev sulfamat, je zaostarec za požar.
Je zmerno strupen.
Sinteza
Sulfámsko kislino dobimo z reakcijo sečnine (NH2)2 Z žveplovo kislino, to je žveplovo kislino (h2SW4) koncentrat, ki vsebuje žveplov trioksid (SO3).
Sintetizira se lahko tudi z reakcijo klorosulfonske kisline (HClo3Cl) in amonijak (NH3).
Prijave
V barvni industriji
Sulfámska kislina se uporablja za hitro in učinkovito odstranjevanje presežnih nitritov v diazotizacijskih reakcijah pri sintezi barvanja. V ta namen je veliko bolj praktičen kot sečnina.
Pri obdelavi usnja
Med usnjenim strojenjem uporaba sulfaminske kisline namesto žveplove kisline zagotavlja tanjšo in bolj svilnato teksturo.
Vam lahko služi: kovinski mineraliKer je kalcijev sulfamat topen v vodi, lahko za razliko od kalcijevega sulfata uporabimo sulfáminsko kislino v nezadovoljnem procesu, ne da bi pustili lise, ki se včasih pojavijo v usnju, kadar se uporablja žveplova kislina.
 Usnjena obutev. Vir: Pixabay.
Usnjena obutev. Vir: Pixabay. V opremi za čiščenje
Sulfámska kislina se uporablja kot čistilec dekalcifikatorjev v vrelih, reaktorjih, ceveh, hladilnih sistemih in toplotnih izmenjevalcih.
V tej opremi se oblikujejo vložki za kroženje vode ali spojin procesa v energetskih rastlinah, kemičnih rastlinah, pristopih, tovarnah papirja, kompresijskih postaj in drugih panogah.
Vložki ali trdna nahajališča so lahko organska (alge, mul, glive) ali anorganski (železovi oksidi, železovi sulfidi, kalcijevi ali magnezijevi karbonati, sulfati, fosfati ali silikati).
Sulfámska kislina je zelo učinkovita, če se uporablja za odpravljanje vložkov kalcijevega karbonata. Uporablja se lahko v bakreni opremi, medenini, nerjavnem jeku, litem železu in pocinkanem jeklom.
Uporablja se v 5-10% raztopini s težo. Uporablja se zlasti v mlinih sladkorja za čiščenje uparjalnikov iz litega železa z bakrenimi toplotnimi izmenjevalci.
 Ekipa uparjalnika v mlinu za sladkor. Avtor: Antiksh Kumar. Vir: Pixabay
Ekipa uparjalnika v mlinu za sladkor. Avtor: Antiksh Kumar. Vir: Pixabay Uporabiti ga je treba pri temperaturah, ki niso večje od 50-60 ° C. 70 ° C temperature vodijo do nastanka netopnih sulfatov, kot je primer4.
Če se uporabljamo v kombinaciji z natrijevim kloridom, pride do sinergijskega učinka in raztopina omogoča, da se železov oksid počasi raztopi. V tem primeru ga ne bi smeli uporabljati z nerjavnim jeklom, ker se sprošča klorovodikova kislina, kar lahko povzroči korozijo v tem materialu.
Pri rafiniranju kovin
Kovinska elektrodepozija, kot so baker, srebro, kobalt, nikelj, cink, kadmij, železo in svinca. To je mogoče obravnavati veliko lažje kot hidrofabilna kisla kislina (H2Sif6).
Kot vzorec reagenta v laboratoriju
Glede na določene značilnosti sulfamične kisline, kot so: njegova sila kot kislina, njena enostavnost očistiti s prekristalizacijo v vodi, njegovo stabilnost in nehidroskopnost. To pomeni, da se uporablja za kvantitativne določitve alkalij.
 Laboratorij. Javne knjige. Vir: Pixabay
Laboratorij. Javne knjige. Vir: Pixabay V analizi nitritov
Zaradi lahke reakcije z nitritom se za določanje le -teh uporablja sulfáminska kislina.
Vam lahko služi: trikloroocetna kislina: struktura, lastnosti, sinteza, uporabe, učinkiV analizi vode, raztopljene v vodi
Ker reakcijska sulfamična kislina z vodnimi nitriti sprošča dušik, je mogoče določiti kisik, raztopljen v vodi, saj se motenj, ki ga povzročajo nitriji.
Pri pripravi dušikovega oksida
Sulfámska kislina reagira z dušikovo kislino, ki ustvarja dušikovo oksid (n2Da). Ta reakcija je varnejša od amonijevega nitrata za pridobitev omenjenega plina.
V kmetijstvu
Derivat sulfáminske kisline, amonijev sulfamat, je netoksični herbicid za živali.
Na listih vrst ga uporablja rosa, ki jo je treba odstraniti ob koncu poletja ali jeseni, po možnosti v vlažnem vremenu. Ko premikate spojino iz listov v korenine, rastlina umre.
 Prijava za herbicid Rocío. Avtor: Zefe Wu. Vir: Pixabay
Prijava za herbicid Rocío. Avtor: Zefe Wu. Vir: Pixabay Druga prednost te spojine je, da se tla ne trajno sterilizirajo. Dejansko bo na terenu na voljo nekaj amonijevega sulfamatnega dušika za rast rastlin v naslednji sezoni.
V ognjevalnih tkaninah
Njegova združljivost s celulozo in značilnimi zaostajajočimi požarnimi pretvorbo amonijevega sulfamata v sredstvo za pridobitev ognjenih tkanin in papirja.
Uporablja se 10% teže tkanine, katerih videz in občutek na dotik ostaja nespremenjen. Tkanina, ko je v uporabi.
Uporabna je zlasti v gledališčih ali podobnih krajih.
 Gledališče. Avtor: Mustangjoe Vir: Pixabay
Gledališče. Avtor: Mustangjoe Vir: Pixabay V različnih aplikacijah
Uporablja se kot katalizator v nekaterih kemičnih reakcijah, kot pri pripravi smole sečnine, ki oblikujejo sečnine. Uporabna je tudi kot baktericid in stabilizator klora v bazenih in kot leseno belilo v celulozi in papirju.
Reference
- Ali.S. Nacionalna knjižnica medicine. (2019). Sulfamična kislina. Okrevano od PubChema.NCBI.NLM.ameriški nacionalni inštitut za zdravje.Gov
- Williams, d.L.H. (2004) Nitrozacija v dušikovih centrih. V reakcijah nitrozacije in kemiji dušikovega oksida. Poglavje 2. Okrevano od Scientirect.com
- Clapp, Leallyn B. (1943). Sulfamična kislina in njegova uporaba. Kem. Educa. 1943, 20, 4, 189. Okrevani iz lokalov.Acs.org
- McDonald, James. (2003). Sulfamična kislina. Okreval od Veoliawatertech.com
- Sastri, v.S. (2010). Upravljanje in nadzor korozije. V Shreirjevi koroziji. Okrevano od Scientirect.com
- Bajpai Pratima. (2018). Razne teme. V Biermannovem priročniku celuloze in papirja. Tretja izdaja. Okrevano od Scientirect.com

