Struktura, lastnosti, uporabe, pomembnost sulfhidrične kisline (H2S)
- 2390
- 453
- Adrian Legros
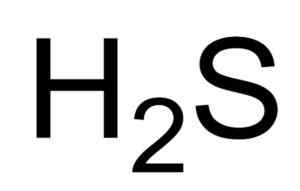
On sulfhidrična kislina O vodikova sulfid je plin, ki ga tvori zveza žveplovih atomov in dveh vodikovih atomov (H). Njegova kemična formula je h2S. Znan je tudi kot sulfidni plin. To je brezbarven plin, katerega vonj postane očiten v gnilem jajcu.
Prisoten je v vulkanih in žveplovih vročih izvirih, v zemeljskem plinu in surovi nafti. Nastaja tudi med anaerobno (brez kisika) razgradnje rastlinskih in živalskih organskih snovi. Pojavlja se naravno v telesu sesalcev, z delovanjem nekaterih encimov na cisteinu, neobsežno aminokislino.
 Kemična formula sulfhidrične kisline ali vodikovega sulfida. Saranphong yimklan [javna domena]. Vir: Wikimedia Commons.
Kemična formula sulfhidrične kisline ali vodikovega sulfida. Saranphong yimklan [javna domena]. Vir: Wikimedia Commons. Vodne rešitve h2S so jedki za kovine, kot je jeklo. H2S je reducirajoča spojina, ki pri reagiranju s SO2 , Oksidira elementarno žveplo, hkrati pa zmanjšuje2 Tudi do žvepla.
Kljub temu, da je zelo strupena in usodna spojina za človeške in živali, je bil njen pomen že nekaj let preučen v vrsti pomembnih procesov v telesu.
Ureja vrsto mehanizmov, povezanih z generiranjem novih krvnih žil in delovanjem srca.
Zaščitite nevrone in razmišljali o svojem delovanju proti boleznim, kot sta Parkinson in Alzheimerjeva.
Zaradi zmanjšanja kemikalij se lahko bori proti oksidacijskim vrstam in tako deluje proti staranju celic. Zaradi teh razlogov se proučuje možnost proizvodnje zdravil, da jo lahko pri oskrbi bolnikom počasi sprostijo znotraj telesa.
To bi služilo za zdravljenje patologij, kot so ishemija, diabetes in nevrodegenerativne bolezni. Vendar je treba njihov mehanizem delovanja in njihovo varnost še vedno poglobljeno raziskati.
[TOC]
Struktura
H molekula2S je analogen vodni, to je, da spominjajo na njihovo obliko, ker se vodiki nahajajo in tvorijo kot z žveplom.
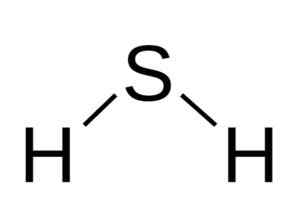 Kotna struktura molekule sulfidne kisline, h2S. Bangin [cc by-sa 3.0 (http: // creativeCommons.Org/licence/by-sa/3.0/]]. Vir: Wikimedia Commons.
Kotna struktura molekule sulfidne kisline, h2S. Bangin [cc by-sa 3.0 (http: // creativeCommons.Org/licence/by-sa/3.0/]]. Vir: Wikimedia Commons. Žveplo v h2S ima naslednjo elektronsko konfiguracijo:
1s2, 2s2 2 p6, 3s2 3P6,
Nato vzemite elektron vsakega vodika, da dokončate svojo valenčno plast.
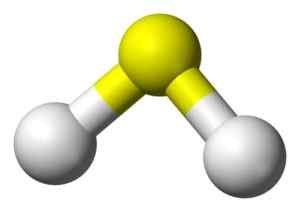 3D struktura sulfidne kisline. Rumena: žveplo. Bela: vodik. Benjah-BMM27 [javna domena]. Vir: Wikimedia Commons.
3D struktura sulfidne kisline. Rumena: žveplo. Bela: vodik. Benjah-BMM27 [javna domena]. Vir: Wikimedia Commons. Nomenklatura
- Sulfhidrična kislina
- Vodikov sulfid
- Žveplovi hidrid.
Fizične lastnosti
Fizično stanje
Brezbarven plin zelo neprijetnega vonja.
Molekularna teža
34,08 g/mol.
Tališče
-85,60 ° C.
Vrelišče
-60,75 ° C.
Gostota
1,1906 g/l.
Topnost
Zmerno topno v vodi: 2,77 volumna v 1 vodi pri 20 ° C. Iz vodne raztopine ga lahko v celoti izselimo tako, da jo predložimo v vrelo.
Kemične lastnosti
V vodni raztopini
Ko je vodikov sulfid v vodni raztopini, se dodeli ime sulfhidrične kisline. Je šibka kislina. Ima dva ionizabilna protona:
H2S + h2Ali ⇔ h3Tudi+ + Hs-, Ka1 = 8,9 x 10-8
Hs- + H2Ali ⇔ h3Tudi+ + S2-, KA2 ∼ 10-14
Prvi proton je rahlo ioniziran, kot je mogoče sklepati iz prve ionizacijske konstante. Drugi proton je zelo malo ioniziran, vendar H -jeve rešitve2S vsebuje nekaj žveplovega aniona S2-.
Če je rešitev H2S je izpostavljen zraku, O2 Oksida za sulfidno anion in žveplo oborine:
Vam lahko služi: oksidi2 s2- + 4 h+ + Tudi2 → 2 h2O + 2 s0↓ (1)
V prisotnosti klora Cl2, BROMO BR2 in jod I2 Nastavljen je ustrezen vodik in žveplo:
H2S + BR2 → 2 HBR + S0↓ (2)
Vodne rešitve h2S so jedki, proizvajajo stres s sulfidom pri visokih trdih jekel. Korozijski izdelki so železo in vodikov sulfid.
Reakcija kisika
H2S reagira s kisikom zraka in lahko pride do naslednjih reakcij:
2 h2S + 3 o2 → 2 h2O + 2 Torej2 (3)
2 h2S + o2 → 2 h2O + 2 s0↓ (4)
Reakcija s kovinami
Reagira z različnimi kovinami, ki se premikajo v vodik in tvorijo kovinski sulfid:
H2S + PB → PBS + H2↑ (5)
Reakcija z žveplovim dioksidom
V vulkanskih plinih so prisotni H2S in tako2, ki se med seboj reagirajo in tvori trdno žveplo:
H2S + tako2 → 2 h2O + 3 s0↓ (6)
Razgradnjo s temperaturo
Vodikov sulfid ni zelo stabilen, zlahka se zlomi s segrevanjem:
H2S → h2↑ + s0↓ (7)
Lokacija v naravi
Ta plin seveda najdemo v sulfidnih ali sulfuroznih vročih vzmeti, v vulkanskih plinih, v surovi nafti in zemeljskem plinu.
 Žveplova voda. NICOLAй MAKSIMOVISH [CC do 3.0 (https: // creativeCommons.Org/licence/by/3.0)]. Vir: Wikimedia Commons.
Žveplova voda. NICOLAй MAKSIMOVISH [CC do 3.0 (https: // creativeCommons.Org/licence/by/3.0)]. Vir: Wikimedia Commons. Kadar nafta (ali plin) vsebuje pomembne sledi H2S naj bi bilo "kislo", v nasprotju z "sladkim", to je takrat, ko ga ne vsebuje.
Majhne količine h2S v nafti ali plinu so ekonomsko škodljivi, ker je treba namestiti pralno rastlino, da jo odstranimo, tako da preprečimo korozijo kot tudi za varstvo preostalega plina za domačo uporabo kot gorivo.
Pojavi se vsakič, ko se v anaerobnih pogojih (odsotnost zraka) razgradi organska snov, ki vsebuje žveplo.
 H emisije2S (modrikasto zelena barva) na obali Namibije, fotografirala NASA. Te emisije izvirajo iz organskih odpadkov. Nasin zemeljski observatorij [CC do 2.0 (https: // creativeCommons.Org/licence/by/2.0)]. Vir: Wikimedia Commons.
H emisije2S (modrikasto zelena barva) na obali Namibije, fotografirala NASA. Te emisije izvirajo iz organskih odpadkov. Nasin zemeljski observatorij [CC do 2.0 (https: // creativeCommons.Org/licence/by/2.0)]. Vir: Wikimedia Commons. Bakterije, ki so prisotne v ustih in v prebavilih, jih proizvajajo iz razgradljivih materialov, ki jih vsebujejo zelenjava ali živalske beljakovine.
Njegov značilen vonj povzroča opozorilo njene prisotnosti v gnilem jajcu.
H2S se pojavlja tudi v nekaterih industrijskih dejavnostih, na primer v rafinerijah nafte, koksa, tovarne papirja, ki bi jih imeli in pri predelavi hrane.
Sinteza v telesu sesalcev
H2S Endogeni se lahko pojavijo v tkivih sesalcev, med temi človeškimi bitji po dveh poteh, encimski in ne -encimski.
Ne -encimska pot je sestavljena iz zmanjšanja osnovnega žvepla0 do h2S skozi oksidacijo glukoze:
2 c6H12Tudi6 (glukoza) + 6 s0 (žveplo) + 3 h2O → 3 c3H6Tudi3 + 6 h2S + 3 CO2 (8)
Vam lahko služi: klor: zgodovina, lastnosti, struktura, tveganja, uporabeEncimska pot je sestavljena iz H H2S iz L-cisteina, ki je aminokislina, ki jo sintetizira telo. Postopek je zavarovano z več encimi, kot je cistacija.
 V možganih krav je bila najdena sulfhidrična kislina. Avtor: ArtTower. Vir: Pixabay.
V možganih krav je bila najdena sulfhidrična kislina. Avtor: ArtTower. Vir: Pixabay. Pridobivanje v laboratoriju ali industrijskem
Vodikov plin (h2) in žveplovi elementi ne reagirajo na normalne okoljske temperature, vendar se nad njimi začnejo kombinirati, optimalna temperatura je 310 ° C.
Postopek je kljub temu prepočasen, zato se za njegovo pridobivanje uporabljajo druge metode, med njimi.
Kovinski sulfidi (na primer železov sulfid) reagirajo s kislinami (kot je klorovodika) v razredčeni raztopini.
FES + 2 HCl → FECL2 + H2S ↑ (9)
Na ta način dobimo plin2S, ki je treba glede na svojo strupenost varno zbrati.
Industrijska uporaba h2S za proizvodnjo žvepla
Skladiščenje in prevoz v velikih količinah h2S, ki se loči od zemeljskega plina z pranjem z amini, je težko, zato se postopek klavsa uporablja za pretvorbo v žveplo.
 V rafinerijah nafte je H ločen2S zemeljskega plina s pranjem z amini in nato postane žveplo. Avtor: Satyaprem. Vir: Pixabay.
V rafinerijah nafte je H ločen2S zemeljskega plina s pranjem z amini in nato postane žveplo. Avtor: Satyaprem. Vir: Pixabay. V tem procesu se pojavita dve reakciji. V prvem h2S reagira s kisikom2, Kot že omenjeno (glej reakcijo 3).
Druga je reakcija, ki jo katalizira železov oksid, kjer je SO2 je zmanjšan in h2S oksidira in oba proizvajata žveplo (glej reakcijo 6).
Na ta način dobimo žveplo, ki ga je mogoče enostavno shranjevati in prevažati, pa tudi dodeliti za večkratno uporabo.
Uporabnost ali pomen h2S Endogeni v organizmu
H2S Endogen je tisti, ki se naravno pojavlja v organizmu kot del običajnega metabolizma pri ljudeh, sesalcih in drugih živih bitjih.
Kljub dolgotrajnemu slovesu, da je strupen in strupeni plin, povezan z razgradnjo organske snovi, je več nedavnih raziskav od 2000 -ih do danes ugotovilo, da je H2S Endogen je pomemben regulator nekaterih mehanizmov in procesov v živo bitje.
H2S predstavlja visoko lipofilnost ali afiniteto do maščob, tako da zlahka prečka celične membrane, prodira v vse vrste celic.
Kardiovaskularni sistem
Pri sesalcih sulfidna kislina spodbuja ali uravnava vrsto signalov, ki uravnavajo presnovo, srčno delovanje in preživetje celic.
Močno vpliva na srce, krvne žile in krožne elemente krvi. Modulira celični presnovni in mitohondrijski funkciji.
Brani ledvice škode, ki jo povzroči ishemija.
Prebavni sistem
Igrajo pomembno vlogo kot zaščitni dejavnik pred poškodbami želodčne sluznice. Ocenjuje se, da je pomemben mediator gibljivosti prebavil.
Verjetno je vključen v nadzor nad izločanjem insulina.
Centralni živčni sistem
Deluje tudi v pomembnih funkcijah centralnega živčnega sistema in ščiti oksidativni stresni nevroni.
 Nevroni so zaščiteni s H2S Endogeni. Avtor: Gerd Altmann. Vir: Pixabay.
Nevroni so zaščiteni s H2S Endogeni. Avtor: Gerd Altmann. Vir: Pixabay. Ocenjuje se, da lahko zaščiti pred nevrodegenerativnimi boleznimi, kot so Parkinsonova Parkinson, Alzheimerjeva in Hungintonova bolezen.
Organ za vizijo
Zaščitite fotoreceptorske celice pred degeneracijo mrežnice, ki jo povzroča svetloba.
Lahko vam služi: litijev karbonat (li2CO3): struktura, lastnosti, uporabeProti staranju
H2S To, da je reducirajoča vrsta, lahko porabijo različna oksidacijska sredstva, ki krožijo v telesu. Boj proti oksidacijskim vrstam, kot so reaktivne kisikove vrste in reaktivne dušikove vrste v telesu.
Omejite reakcije prostih radikalov z aktiviranjem antioksidantnih encimov, ki ščitijo pred učinki staranja.
Zdravilni potencial h2S dobavljeno eksogeno
Biološka uporabnost h2S Endogeni je odvisen od nekaterih encimov, ki sodelujejo pri biosintezi cisteina pri sesalcih.
Nekatere študije kažejo, da darovalec terapije z zdravili don2S bi lahko bil koristen za nekatere patologije.
Na primer, lahko je koristno pri bolnikih s sladkorno boleznijo, saj je bilo opaziti, da se krvne žile diabetičnih živali izboljšujejo z zdravili, ki oskrbujejo h2S eksogeno.
H2S pod pogojem, da eksogeno poveča angiogenezo ali nastajanje krvnih žil, tako da bi lahko služil za zdravljenje kroničnih ishemijskih bolezni.
Načrtujejo zdravila, ki se lahko sprostijo h2S počasi, da lahko dobro ravnate o različnih boleznih. Vendar je treba še vedno raziskati učinkovitost, varnost in mehanizme njihovega delovanja.
Tveganja
H2S je smrtni strup, če ga vdihavamo čisti ali celo razredčen 1 del plina v 200 delih zraka. Ptice so zelo občutljive na h2S in umrejo tudi v redčenju 1 v 1500 delih zraka.
 Sulfidna kislina ali vodikov sulfid h2S je močan strup. Avtor: OpenIcons. Vir: Pixabay.
Sulfidna kislina ali vodikov sulfid h2S je močan strup. Avtor: OpenIcons. Vir: Pixabay. H2S je močan zaviralec nekaterih encimov in oksidativnih fosforilacijskih procesov, kar vodi v celično zadušitev. Večina ljudi ga dojema v koncentracijah, večjih od 5 ppb (deli na milijardo). Koncentracije 20-50 ppm (deli na milijon) dražijo za oči in dihalne trakt.
Inhalacija 100-250 ppm za nekaj minut lahko ustvari pomanjkanje koordinacije, motnje pomnilnika in motorične motnje. Ko je koncentracija približno 150-200 ppm2S. Če 30 minut vdihavamo koncentracija 500 ppm, lahko proizvedemo pljučni edem in pljučnica.
Koncentracije več kot 600 ppm so lahko usodne v prvih 30 minutah, saj je dihalni sistem paraliziran. In 800 ppm je koncentracija, ki je za človeka takoj smrtna.
Zato se je treba izogniti, da obstajajo h pobegi2S v laboratorijih, lokalnih ali kjer koli ali v situaciji.
Pomembno je opozoriti, da se pojavi veliko smrti, ker ljudje vstopajo v prostore, zaprte na reševanje sodelavcev ali družinskih članov, ki so se zrušili zaradi zastrupitve z H2S, tudi umira.
Je vnetljiv plin.
Reference
- Panthi, s. et al. (2016). Fiziološki pomen vodikovega sulfida: nastajajoči nevroprotektor in nevromodulator potent. Oksidativna zdravila in celična dolgoživost. Zvezek 2016. ID članka 9049782. Hyndawi si je opomogel.com.
- Shefa, u. et al. (2018). Funkcije antioksidantov in celičnih signalov vodikovega sulfida v centralnem živčnem sistemu. Oksidativna zdravila in celična dolgoživost. Zvezek 2018. ID članka 1873962. Hyndawi si je opomogel.com.
- Tabassum, r. et al. (2020). Terapevtski pomen vodikovega sulfida pri starostnih nevrodegenerativnih boleznih. Neural Regen Res 2020; 15: 653-662. Nrronline je bil obnovljen.org.
- Martelli, a. et al. (2010). Vodikov sulfid: Nova priložnost za odkrivanje drog. Pregledi raziskav zdravil. Zvezek 32, številka 6. Pridobljeno iz spletne knjižnice.Wiley.com.
- Wang, m.-J. et al. (2010). Mehanizmi angiogeze: vloga vodikovega sulfida. Klinična in eksperimentalna farmakologija in fiziologija (2010) 37, 764–771. Pridobljeno iz spletne knjižnice.Wiley.com.
- Dalefield, r. (2017). Dim in drugi vdihani toksikont. Vodikov sulfid. V veterinarski toksikologiji za Avstralijo in Novo Zelandijo. Okrevano od Scientirect.com.
- Selley, R.C. in Sonnenberg, s.Do. (2015). Fizikalne in kemijske lastnosti nafte. Vodikov sulfid. V elementih naftne geologije (tretja izdaja). Okrevano od Scientirect.com.
- Hocking, m.B. (2005). Žveplo in žveplova kislina. Claus Proces pretvorba vodikovega sulfida v žveplo. V priročniku za kemijsko tehnologijo in nadzor onesnaževanja (tretja izdaja). Okrevano od Scientirect.com.
- Lefer, d.J. (2008). Potencialni pomen sprememb v vodikovem sulfidu (h2S) Biološka uporabnost pri sladkorni bolezni. British Journal of Pharmacology (2008) 155, 617–619. Pridobljeno iz bpspubs.Spletna knjižnica.Wiley.com.
- Ali.S. Nacionalna knjižnica medicine. (2019). Vodikov sulfid. Okrevano od: pubchem.NCBI.NLM.ameriški nacionalni inštitut za zdravje.Gov.
- Pristanišče, j.Do. in ibarz, j. (1965). Sodobna splošna kemija. 7. izdaja. Marín uvodnik, s.Do.
- « Izvor, značilnosti, načela, primeri socialističnega izobraževanja
- Zgodovina, značilnosti, predstavniki neoklasičnega gledališča, dela »

