Hiposulfurozna kislina
- 4292
- 730
- Ricky Dach
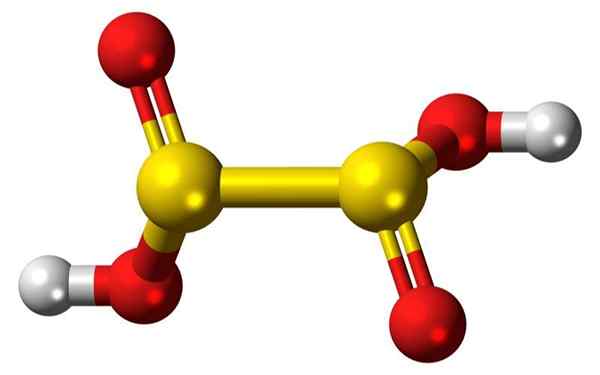
 3d palice palic in balonov hiposulvske kislinske molekule. Vir: Jynto
3d palice palic in balonov hiposulvske kislinske molekule. Vir: Jynto Kaj je hiposulvov kislina?
On Hiposulfurozna kislina, O dionska kislina je neznana, nestabilna izključno, nima neodvisnega obstoja in ni bila odkrita v vodni raztopini.
Teoretično bi bila razmeroma šibka kislina, primerljiva z žveplovo kislino, H2SO3. Znane so le njihove soli, dionitos, ki so stabilni in so močni reducirajoči sredstva. Sol natrijeve dionske kisline je natrijev dionito.
Formule
Formule za hiposulfilozne kisline so naslednje:
Dionska kislina: H2S2Tudi4
Dionito anion: S2O42−
Natrijev dionito: na2S2Tudi4
Številka CAS: 20196-46-7 Hiposulvozna kislina (ali dital)
Številka CAS: 14844-07-6 hiposulvsko kislino (ali dition, ion)
Številka CAS: 7775-14-6 Natrijev dionito (natrijev natrij supernice)
Fizikalne in kemijske lastnosti
- V soli natrijeve dionito je njegov videz kristalni, bel do sivkast prah, s kosmiči lahke in šibke limonine zelene.
- Molekulska masa ditativne kisline je 130.132 g/mol. Dionito anion, 128.116 g/mol in natrijev dionito, 174.096 g/mol.
- Na vrelišču natrijevega dionita se razgradi, njegova tališče pa je 52 ° C.
- Gostota natrijevega dionita je 2.38 g/cm³ (brezvodna), njegova topnost v vodi pa je 18.2 g/100 ml (brezvodna, 20 ° C).
- Hiposulvska kislina je žveplova oksocid s kemijsko formulo H2S2Tudi4.
- Žveplovi oksoacidi so kemične spojine, ki vsebujejo žveplo, kisik in vodik. Vendar pa so nekateri znani le po svojih soli (na primer hiposulvsko kislino, diticijske kisline, disulfidne kisline in žveplove kisline).
Lahko vam služi: piridin: struktura, lastnosti, uporabe, strupenost, sintezaMed strukturnimi značilnostmi oksocidov imamo:
- Tetraedrski žveplo, ko je usklajen s kisikom.
- Atomi kisika v mostu in terminalu.
- Periodinalne skupine.
- S = s terminali.
- Verige (-s-) n
Žveplova kislina je najbolj znana žveplova oksocid.
- Dionito anion2Tudi4] 2-) je oksoanion (ion z generično formulo Axoy z-) žvepla, ki je formalno pridobljen iz diticijske kisline.
- Dionito ioni doživljajo kislinsko in alkalno hidrolizo do tiosulfata in bisulfita ter sulfita in sulfida.
- Sol natrijeve dionske kisline je natrijev dionit (znan tudi kot natrijev hidrosulfit).
- Dobimo ga lahko iz natrijevega bisulfita z naslednjo reakcijo:
2 NaHSO3 + Zn → na2SW4 + Zn (OH) ²
Prijave
Dionitni ion se pogosto uporablja v povezavi s kompleksnim sredstvom (na primer citronsko kislino), da se zmanjša železov oksi-hidroksid (III) v topnih železnih spojinah (II) in odpravi amorfne faze mineralov, ki vsebujejo železo (III) v tleh Analiza (selektivna ekstrakcija).
Dionito omogoča povečanje topnosti železa. Zahvaljujoč močni afiniteti Ion Dionito za dvovalentne in trivalentne kovinske katione se uporablja kot kelacijsko sredstvo.
Dionitova razgradnja proizvaja zmanjšane vrste žvepla, ki so lahko zelo agresivne za korozijo jekla in nerjavečega jekla.
Med aplikacijami natrijevega dionita imamo:
V industriji
- Ta spojina je vodna topna sol in jo je mogoče uporabiti kot reducirsko sredstvo v vodnih raztopinah.
- Uporablja se kot taka v nekaterih industrijskih barvilnih procesih, predvsem tistih, ki vključujejo žveplove barvila in barvila za kad, pri katerih se lahko vodno netopno barvilo zmanjša na vodotopno alkalno kovinsko sol (na primer indigo barvilo).
Vam lahko služi: kisline: značilnosti in primeri- Natrijeve dionito redukcijske lastnosti prav tako odpravljajo odvečno barvilo, preostali oksid in neželene pigmente, s čimer se izboljša globalna kakovost barve.
- Natrijev dionito se lahko uporablja tudi za čiščenje vode, čiščenje plina, čiščenje in ekstrakcijo. Uporablja se lahko tudi v industrijskih procesih, kot sta sulfonančni agent ali vir natrija.
- Poleg tekstilne industrije se ta spojina uporablja v usnjenih panogah, hrani, polimerih, fotografijah in mnogih drugih. Uporablja se tudi kot razgradnje v organskih reakcijah.
V bioloških znanostih
- Natrijev dionito se pogosto uporablja v fizioloških poskusih kot sredstvo za zmanjšanje redoks potenciala rešitev.
V geoloških znanostih
- Natrijev dionito se pogosto uporablja v poskusih s kemijo v tleh za določitev količine železa, ki ni vgrajena v primarne silikatne minerale.
Varnost in tveganja
Manipulacija tega elementa je treba opraviti v izjemnih pogojih nege. Je izjemno strupen in lahko nevarno reagira v povezavi z vodo in zrakom.
Nato izpostavimo nekatere vidike.
Reakcije zraka in vode
- Natrijev dionito je trdno gorivo, ki počasi razpade, ko je v stiku z vodo ali vodno paro, ki tvori tiosulfate in bisulfite.
- Ta reakcija povzroči toploto, ki lahko še pospeši reakcijo ali povzroči, da okoliški materiali gorijo. Če je zmes omejena, lahko reakcija razgradnje povzroči pritisk posode, ki jo je mogoče močno razbiti. Ko ostane v zraku, se počasi oksidira in ustvarja strupene sulfur dioksidne pline.
Vam lahko služi: nitrofurans: značilnosti, mehanizem delovanja in klasifikacijePožarna nevarnost
- Natrijev dionito je vnetljiv in gorljiv material. Lahko vnesemo na stik z mokrim zrakom ali vlago. Lahko hitro goriš z učinkom na. Lahko močno ali eksplozivno reagira v stiku z vodo.
- Lahko eksplozivno razgradimo, ko se ogreje ali je vključen v požar. Se lahko spet vklopi po ugasnjenem požaru. Odtok lahko ustvari nevarnost požara ali eksplozije. Posode lahko eksplodirajo, ko se segrejejo.
Zdravstvena nevarnost
- Natrijev dionito bo ob stiku z ognjem povzročil dražilne, jedke in/ali strupene pline. Vdihavanje produktov razgradnje lahko povzroči resne poškodbe ali smrt. Stik s snovjo lahko povzroči resne opekline na koži in očmi. Odtok požara lahko povzroči kontaminacijo.
Reference
- Benjah-BMM27 (2006). Model kroglice in palice ditionitnega iona [slike].Wikipedija.org.
- Mills, b. (2009). Natrij-ditionit -xtal-1992-3D-Balls [slika], obnovljeno od: In.Wikipedija.org.

