Fosforna kislina (H3PO4)
- 1495
- 323
- Ignacio Barrows
 Posamezna molekula fosforne kisline
Posamezna molekula fosforne kisline Kaj je fosforna kislina?
On fosforna kislina To je okso kislina fosforja, ki ima kemijsko formulo H3Po4. Sestavljen je iz mineralne kisline, v kateri so trije kislinski protoni povezani s fosfatnim anionom (PO43-). Čeprav se ne šteje za močno kislino, ima lahko neprimerna uporaba tveganje za zdravje.
Najdemo ga v dveh stanjih: kot trdna snov v obliki debelih ortrorombičnih kristalov ali kot kristalni sirup -tekočina, ki gleda na tekočino. Njegova najbolj običajna komercialna predstavitev ima koncentracijo 85% P/P in gostoto 1.685 g/cm3. Ta gostota izvira iz roke koncentracije.
Tri skupine OH so odgovorne za darovanje kislinskih vodikov. Zaradi njihove prisotnosti v njihovi strukturi lahko reagirate z različnimi hidroksidi, kar povzroča več soli.
V primeru natrijevega hidroksida lahko oblikujete tri: monobazični natrijev fosfat (ne2Po4), Dibasični natrijev fosfat (NA2HPO4) in tribasični natrijev fosfat (NA3Po4).
Vendar, odvisno od tega, katera baza se uporablja za nevtralizacijo ali katere kationi so ji zelo blizu, lahko tvorite druge fosfatne soli. Med njimi so: kalcijev fosfat (CA3(Po4)2), Litijev fosfat (li3Po4), železni fosfat (fepo4), in drugi. Vsak z različnimi stopnjami protonacije fosfatnega aniona.
Po drugi strani pa lahko fosforjeva kislina "ugrabi" dvovalentne katione, kot je vera2+, Cu2+, AC2+ in mg2+. Pri visokih temperaturah lahko reagirate s seboj z izgubo molekule H2Ali oblikovanje premerov, obrezovanja in polimerov fosfornih kislin.
Ta vrsta reakcije omogoča, da ta spojina vzpostavi veliko število struktur s fosforjevimi in kisikovimi okostji, iz katerih je mogoče dobiti tudi široko paleto znanih soli, kot so polifosfati.
Glede svojega odkritja ga je leta 1694 sintetiziral Robert Boyle (1627-1691)2Tudi5 (Fosfor pentoksid) v vodi. Je ena najbolj uporabnih mineralnih kislin, saj je njegova funkcija kot gnojilo najpomembnejše.
Fosfor, kalij in dušik predstavljajo tri glavne hranilne snovi rastlin.
Struktura kemične fosforne kisline
 Struktura kemične fosforne kisline
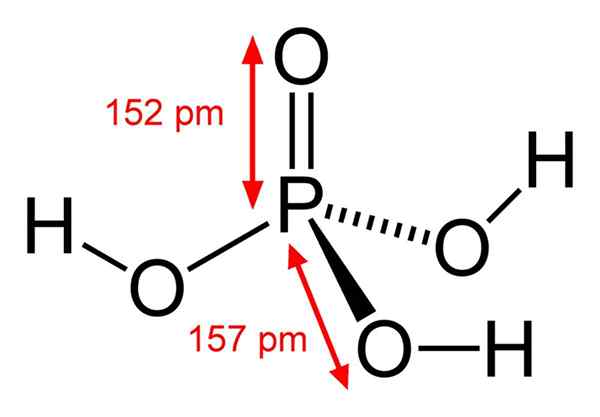
Struktura kemične fosforne kisline Fosforna kislina je sestavljena iz P = O vezi. Z atomom fosforja v sredini, kisik nariše neke vrste molekularni tetraedron.
Na ta način lahko fosforno kislino vizualiziramo kot tetraedron. S tega vidika te tetraedre (po H enotah3Po4) medsebojno komunicirajo z vodikovimi mostovi; to pomeni, da se njihovi vrhovi natančno približajo.
Te medmolekularne interakcije omogočajo kristalno fosforno kislino v dveh trdnih snovi: brezvodni in hemihidrat (H3Po4· 1/2h2O), oba z monoklinskimi kristalnimi sistemi. Njegova oblika anhidra je mogoče opisati tudi s formulo: 3h2Ali · p2Tudi5, ki je enak trihidriranemu fosforjevemu pentoksidu.
Tetrahedra se lahko celo kovalentno poveže, toda za to mora ena od njenih enot odpraviti molekulo vode z dehidracijo. To se zgodi, ko h3Po4 Se ogreva in posledično ustvarja tvorbo polifosferskih kislin (PA).
Diposforna kislina (h4Str2Tudi7)
Najpreprostejša od vseh PA je diposforna kislina (H4Str2Tudi7), znana tudi kot pirofosforna kislina. Kemična enačba tvoje tvorbe je naslednja:
Lahko vam služi: aluminijev fosfat (ALPO4): struktura, lastnosti, pridobivanje, uporabe2H3Po4 H4Str2Tudi7 + H2Tudi
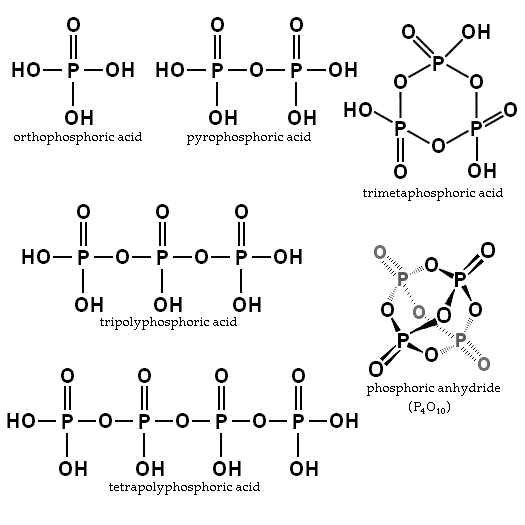
Ravnotežje je odvisno od količine vode in temperature. Kakšna je njegova struktura? Na sliki odseka so v zgornjem levem kotu prikazane strukture ortofosfahične in pirofosforne kisline.
Ko se izloči molekula vode. Zdaj niso trije kisli vodik, ampak štiri (štiri skupine -OH). Zaradi tega h4Str2Tudi7 predstavlja štiri K konstante kdo.
Polifosforne kisline
Dehidracija se lahko nadaljuje s pirofosforno kislino, če se segrevanje nadaljuje. Ker? Ker na vsakem koncu molekule obstaja skupina OH, ki jo je mogoče izločiti kot molekula vode, s čimer spodbuja kasnejšo rast skeleta P-O-O-O-P ... P ..
Primeri teh kislin so trimfosforne in tetropoliforične kisline (obe prikazani tudi na prejšnji sliki). Vidimo, kako se okostje P-O-P podaljša v nekakšni verigi, ki jo tvori tetrahedre.
Te spojine so lahko predstavljene s formulo HO (PO2OH)xH, kjer je ho levi konec, ki lahko dehidrira. Po2Oh je fosforjev okostje s povezavami P = O in OH; In X so enote ali molekule fosforjeve kisline, potrebne za pridobitev omenjene verige.
Ko so te spojine popolnoma nevtralizirane, izvirajo tako imenovani polifosfati. Glede na to, katere katione so obkrožene, tvorijo široko paleto polifosfatnih soli.
Po drugi strani pa, če reagirajo z alkoholi ROH, vodijo vodilnike z alkilnimi substituenti R-. Tako nastanejo fosfatni estri (ali polifija): RO (PO2Ali)xR. Dovolj je, da nadomestite H z R vsemi strukturami slike odseka, da jih pridobite.
Ciklične polifosforne kisline
P-O-P verige lahko celo zaprete v obroču ali fosforju. Najpreprostejša od te vrste spojine je trimetafosforna kislina (zgornji desni kot slike). Tako so PA lahko linearni, ciklični; ali če imajo njihove strukture obe vrsti, razvejani.
Nomenklatura
 Fosforna kislina. Vir: Commons.Wikimedia.org
Fosforna kislina. Vir: Commons.Wikimedia.org Nomenklatura fosforjeve kisline vlada IUPAC in kako so poimenovane nične soli oksocidov.
Ker v h3Po4 Atom P ima Valencijo +5, ki ima največjo vrednost, kislina je dodeljena priponi -ico pred fosforno predpono-.
Ortho-
Vendar pa fosforna kislina pogosto rečeno ortofosforna kislina. Ker? Ker je beseda 'orto' grška in pomeni 'resnična'; kar bi povzročilo "resnično obliko" ali "bolj hidrirano".
Ko je fosforni anhidro hidriran s presežkom vode (P4Tudi10, "Vrhunska slika" Cap ")3Po4 (3H2Ali · p2Tudi5). Tako se Ortho predpona podeli tistim kislinam, ki nastanejo z obilno vodo.
Piro-
PIRO predpona se nanaša na vsako spojino, ki je nastala po nanosu toplote, saj diposforna kislina izhaja iz toplotne dehidracije fosforne kisline. Zato se imenuje pirofosforna kislina (2h2Ali · p2Tudi5).
Cilj-
Ciljna predpona, ki je tudi grška beseda, pomeni 'po'. Dodane se tistim snovi, katerih formula je v tem primeru odpravila molekulo:
H3Po4 => HPO3 + H2Tudi
Upoštevajte, da tokrat dodajanje dveh fosfornih enot ne nastane, da tvori diposforno kislino, ampak namesto metafosforne kisline dobimo (iz katere ni dokazov o njegovem obstoju).
Vam lahko služi: etilni alkohol: struktura, lastnosti, uporabe, pridobivanjePomembno je tudi poudariti, da lahko to kislino opišemo kot h2Ali · p2Tudi5 (Podobno kot s hemidratom, pomnoževanje HPO3 Za 2). Meta- predpona je popolnoma glede na ciklični PA, saj če Trfosforna kislina postane dehidrirana, vendar ne doda druge enote H3Po4 Če želite postati tetrafosforna kislina, morate oblikovati prstan.
In to je enako pri drugih polimeetofosforjevih kislinah, čeprav IUPAC priporoča, da jih pokliče kot ciklične spojine ustreznega PAS.
Lastnosti fosforne kisline
Molekularna formula
H3Po4
Molekularna teža
97.994 g/mol
Fizični videz
V svoji trdni obliki predstavlja ortorrombične, higroskopske in prozorne kristale. V tekoči obliki je kristalna, z videzom viskoznega sirupa.
Komercialno ga dosežemo v vodni raztopini s koncentracijo 85% P/P. V vseh teh predstavitvah nima vonja.
Vrele in fuzijske točke
158 ° C (316 ° F A 760 mmHg).
108 ° F (42,2 ° C).
Topnost vode
548 g/100 g H2Ali 20 ° C; 369,4 g/100 ml pri 0,5 ° C; 446 g/100m pri 14,95 ° C.
Gostota
1.892 g/cm3 (trdno); 1.841 g/cm3 (100%rešitev); 1.685 g/cm3 (85%rešitev); 1.334 g/cm3 50%raztopina) pri 25 ° C.
Gostota pare
Zračni sorodnik 3.4 (zrak = 1).
Samožitev
Ni vnetljivo.
Goo
3,86 mpoise (40% do 20 ° C).
Kislost
PH: 1,5 (0,1 N raztopina v vodi)
PKA: PKA1 = 2,148; PKA2 = 7,198 in PKA3 = 12,319. Zato je njegov najbolj kisli vodik prvi.
Razgradnja
Ko se segreje, sprosti fosforjeve okside. Če se temperatura dvigne na 213 ° C ali več, postane pirofosforna kislina (H4Str2Tudi7).
Jedkost
Jedko za železove kovine in aluminij. Ko reagirate s temi kovinami.
Polimerizacija
Nasilno polimeriza z prevar.
Uporaba fosforjeve kisline
Fosphat in General uporabljata prodajo
-Fosforna kislina služi kot osnova za izdelavo fosfata, ki se uporabljajo kot gnojila, ker je fosfor glavno hranilo rastlin.
-Uporablja se pri zdravljenju vodilne zastrupitve in drugih stanj, v katerih so potrebne pomembne količine fosfata in proizvodnja blage acidoze.
-Uporablja se za nadzor pH mink in mačk sečil, da se izognete tvorbi izračunov ledvic.
-Fosforna kislina povzroča soli na2HPO4 in ne2Po4 ki predstavljajo sistem pH amortizerja s PKA 6,8. Ta pH regulativni sistem je prisoten pri ljudeh, ki ima pomen pri regulaciji medceličnega pH, pa tudi pri upravljanju koncentracije vodika v distalnih in zbiralnih tubulih nefronov.
-Uporablja se pri izločanju mohosa plasti železovega oksida, ki se kopiči na tej kovini. Fosforna kislina tvori železov fosfat, ki ga je mogoče enostavno odstraniti s kovinske površine. Uporablja se tudi v aluminijastem električnem laku.
Industrijalisti
-Fosforna kislina je usojena kot katalitično sredstvo pri izdelavi najlona in bencina. Uporablja se kot dehidralno sredstvo v litografskem graviranju, pri izdelavi barvil za uporabo v tekstilni industriji, v procesu koagulacije lateksa v obali in pri čiščenju vodikovega peroksida (vodikov peroksid (vodikov peroksid).
-Kislina se uporablja kot dodatek v brezalkoholnih pijačah, ki na ta način prispeva k svojemu okusu. Razredčen, se uporablja v postopku rafiniranja sladkorja. Pri pripravi šunke, želatine in antibiotikov deluje tudi kot sistem za udarce.
Vam lahko služi: aluminijev hidroksid: struktura, lastnosti, uporabe, tveganja-Posega v izdelavo detergentov, v kislinsko katalizo proizvodnje acetilena.
-Uporablja se kot kislina v uravnoteženi hrani za živinoreje in hišne ljubljenčke. Farmacevtska industrija jo uporablja pri proizvodnji protiemetičnih zdravil. Izkoristi tudi mešanico za asfalt za tlakovanje tal in popravi razpoke.
-Fosforjeva kislina deluje kot katalizator v reakciji hidratacije alkenov, da proizvaja alkohol, predvsem etanol. Poleg tega se uporablja pri določanju organskega premoga v tleh.
Zobna
Uporabljajo ga zobozdravniki za čiščenje in stanje zobne površine pred namestitvijo zobnih nosilcev. Uporablja se tudi pri beljenju zob in izločitvi zobnih plošč. Poleg tega se uporablja pri proizvodnji lepila za zobne proteze.
Kozmetika
Fosforna kislina se uporablja za prilagajanje pH pri izdelavi kozmetičnih izdelkov in za nego kože. Uporablja se kot kemično oksidacijsko sredstvo za proizvodnjo aktivnega oglja.
Tvorba fosforne kisline
-Fosforna kislina se pripravi iz fosfatnih kamnin tipa apatita s svojo koncentrirano prebavo žveplove kisline:
AC3(Po4)2 + 3 h2SW4 + 6 h2O => 2 h3Po4 + 3 (primer4.2H2Da)
Fosforjeva kislina, pridobljena v tej reakciji, je nizka čistost, zato je v postopku čiščenja, ki vključuje padavine, ekstrakcijo topila, kristalizacijo in tehnike izmenjave ionov.
-Fosforna kislina se lahko pojavi z raztapljanjem fosforjevega pentoksida v vreli vodi.
-Dobimo ga lahko tudi s segrevanjem fosforja z mešanico zraka in vodne pare:
Str4 (l) +5 o2 (g) => p4Tudi10 (S)
Str4Tudi10 (s) +h2Ali (g) => 4h3Po4 (L)
Tveganja
-Ker je vaš parni tlak pri sobni temperaturi nizek, je malo verjetno, da bi lahko hlapi vdihnili, razen če se kislina razprši. Če je tako, simptomi njihovega vdihavanja vključujejo: kašelj, vneto grlo, kratko in naporno dihanje.
-V literaturi se navaja primer mornarja, ki je bil dolgo časa izpostavljen hlapom fosforjeve kisline. Utrpela splošno šibkost, suh kašelj, bolečine v prsih in dihalne težave. Po enem letu po razstavi so opazili reaktivno disfunkcijo dihalnega trakta.
-Kožni stik s fosforno kislino lahko povzroči pordelost, bolečino, mehurje in opekline kože.
-Stik kisline z očmi, odvisno od njegove koncentracije in trajanja stika, lahko v teh, tkivih jedko lezij ali hude opekline s trajnimi očesnimi poškodbami nastanejo.
-Zaužitje s kislino povzroča opekline v ustih in grlu, občutek ardorja onkraj prsnice, bolečine v trebuhu, bruhanje, šok in propad.
Reference
- Royal Society of Chemistry. (2015). Fosforna kislina. Vzet od: Chemspider.com
- Kanadski center za zdravje in varnost pri delu. (1999). Fosforna kislina - učinki na zdravje. Vzet iz: ccsso.AC
- Kisline.Informacije. (2018). Različna uporaba te kemične spojine. Vzeti iz: kisline.Informacije
- James P. Smith, Walter E. Brown in James R. Lehr. (1955). Struktura kristalne fosforne kisline. J. A.M. Kem. Soc. 77, 10, 2728-2730
- Wikipedija. (2018). Fosforne kisline in fosfati. Vzeto od: v.Wikipedija.org
- Znanost je zabavna. Spoznajte fosforno kislino. [PDF]. Vzet od: scifun.Kem.WISC.Edu

