Fosforna kislina (H3PO3)
- 2701
- 260
- Miguel Gutmann DVM
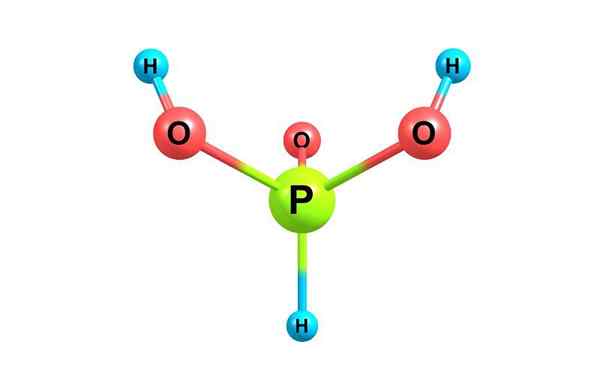
 Kemična struktura fosforne kisline. Z licenco
Kemična struktura fosforne kisline. Z licenco Kaj je fosforna kislina?
On fosforna kislina, Imenuje se tudi ortofosfatirajoča kislina, je kemična spojina formule H3Po3. Je ena od različnih kislinskih kislin fosforja in njegova struktura je predstavljena na zgornji sliki.
Glede na sestavljeno formulo je to mogoče napisati kot HPO (OH)2. Ta vrsta obstaja v ravnovesju z manjšim tavtomerjem P (OH)3.
Priporočila IUPAC, 2005, so, da se slednji imenuje fosforna kislina, medtem ko se oblika dihidroksi imenuje fosfonska kislina. Samo zmanjšane fosforjeve spojine so uroki s "medvedom".
Fosforna kislina je diprotična kislina, to pomeni, da ima možnost le dva protona. To je zato, ker je večinski tautomer h3Po3.
Ko ta oblika izgubi proton, resonanca stabilizira oblikovane anione. P (OH) Tautomero 3 nima koristi od stabilizacije resonance. To otežuje odprava tretjega protona.
Fosforna kislina (h3Po3) Prodaja, imenovana fosfiti, ki se uporabljajo kot reducirajoča sredstva. Pripravimo ga z raztapljanjem tetrafosforovega heksoksida (P4Tudi6) V skladu z enačbo:
Str4Tudi6 + 6 H₂o → 4 HPO (OH)2
Čista fosforna kislina, h3Po3, Bolje ga pripravimo s hidrolizo fosforja triklorida, pcl3.
Pcl3 + 3H2O → HPO (OH)2 + 3HCl
Nastala raztopina segreva, da izgnate HCl, preostala voda pa izhlapi, dokler se ne pojavi 3Po3 Kristalno barvito pri hlajenju. Kislino lahko dobimo tudi z vodnim delovanjem na PBR3 ali pi3.
Fizikalne in kemijske lastnosti fosforna kislina
- Fosforna kislina je bela ali rumena higroskopska tetraedrska kristal, z aromo, podobno česnamu.
Vam lahko služi: nenasičena rešitev- H3Po3 Ima molekulsko maso 82,0 g/mol in gostoto 1.651 g/ml.
- Spojina ima tališče 73 ° C in se razgradi nad 200 ° C.
- V vodi je topen, saj lahko raztopi 310 gramov na 100 ml tega topila. V etanolu je tudi topen.
- To je močna kislina s PKA med 1,3 in 1,6.
- Ogrevanje fosforne kisline pri približno 200 ° C je nesorazmerno na fosfornici in fosfinu (pH3). Fosfin je plin, ki se v zraku običajno vklopi spontano.
4H3Po3 + Toplota → pH3 + 3H3Po4
Reaktivnost in nevarnosti
Reaktivnost
- Fosforna kislina ni stabilna spojina.
- Absorbira zračni kisik, da tvori fosforno kislino.
- Tvorijo rumene nahajališča v vodni raztopini, ki jih je pri sušenju spontano vnetljivo.
- Reagirati eksotermično s kemičnimi osnovami (na primer: anorganski amini in hidroksidi), da tvorijo soli.
- Te reakcije lahko ustvarijo nevarno velike količine toplote v majhnih prostorih.
- Raztapljanje vode ali redčenje koncentrirane raztopine z dodatno vodo lahko povzroči znatno toploto.
- Reagira v prisotnosti vlažnosti z aktivnimi kovinami, vključno s strukturnimi kovinami, kot sta aluminij in železo, za sproščanje vodika, vnetljivega plina.
- Lahko začnete s polimerizacijo nekaterih alkenov. Reagira s cianidnimi spojinami, da sprosti plinasti vodikov cianid.
- Lahko ustvari vnetljive in / ali strupene pline v stiku z ditiokarbamatom, izociati, trgovci, nitridi, nitrili, sulfidi in močnimi reducirajočimi sredstvi.
- Dodatne reakcije za ustvarjanje plina nastajajo s sulfiti, nitriji, tiosulfati (da bi dajali H2 in SO3), dionitos (dati SO2) in karbonatom (da se daje Co₂).
Lahko vam služi: Einstenio (S): struktura, lastnosti, pridobivanje, uporabeNevarnosti
- Spojina je jedska za oči in kožo.
- Stik z očmi lahko povzroči poškodbe roženice ali slepoto.
- Kožni stik lahko povzroči vnetje in pretisne omote.
- Inhalacijo prahu bo povzročilo draženje prebavil ali dihalnih traktov, za katerega je značilno, da gorenje, kihanje in kašljanje.
- Huda prekomerna izpostavljenost lahko povzroči poškodbe pljuč, zadušitev, izgubo znanja ali smrti.
Ukrep v primeru škode
- Prepričajte se, da se zdravstveno osebje zaveda vpletenih materialov in sprejme varnostne ukrepe za zaščito.
- Žrtev je treba preseliti na novo mesto in poklicati službo za nujno medicinsko pomoč.
- Če žrtev ne diha, je treba dati umetno dihanje.
- Metoda do ust do ust ne smete uporabljati, če je žrtev zaužila ali vdihavala snov.
- Umetno dihanje se izvaja s pomočjo žepne maske, opremljene z enosmernim ventilom ali drugo ustrezno dihalno napravo.
- Kisik je treba dajati, če je težko dihanje.
- Onesnažena oblačila in čevlje je treba odstraniti in izolirati.
- V primeru stika s snovjo kožo ali oči takoj izperite s tekočo vodo vsaj 20 minut.
- Za nižji stik s kožo se je materialu izogibati na koži neobdelane kože.
- Naj bo žrtev mirna in vroča.
- Učinke izpostavljenosti (vdihavanje, zaužitje ali stik s kožo) lahko zavlečete.
Uporabe fosforna kislina
- Najpomembnejša uporaba fosforne kisline je proizvodnja fosfitov, ki se uporabljajo pri čiščenju vode. Fosforna kislina se uporablja tudi za pripravo fosfitnih soli, kot je kalijev fosfit.
Vam lahko služi: Boyle Law- Fosfiti so pokazali učinkovitost pri nadzoru različnih rastlin.
- Zlasti je zdravljenje z injiciranjem debla ali foliar, ki vsebuje fosforne kislinske soli, indiciran kot odziv na okužbe zaradi rastlinskih patogenov fitoftera in pitijeve vrste (ustvarite razgradnjo korenine).
- Fosforna kislina in fosfiti se uporabljajo kot reducirajoča sredstva v kemični analizi. Nova priročna in razširljiva sinteza fenilacetnih kislin z redukcijo, ki jo katalizira jodid mandele kisline. Za to se fosforna kislina uporablja kot stehiometrični reduktor.
- Uporablja se kot sestavina za proizvodnjo dodatkov, ki se uporabljajo v industriji Poli (vinil klorid). V več reakcijah organske sinteze se uporabljajo tudi estri fosforne kisline.
Reference
- Fosforna kislina (H3PO3). Okreval od Britannice.com.
- Mushonska kislina. Okreval od EBI.AC.Združeno kraljestvo.

