Kaj je disulfrično, kaj je, struktura, lastnosti, uporablja
- 694
- 112
- Dexter Koch
Kaj je disulfrinska kislina?
On disulfrinska kislina Je eden izmed številnih žveplovih oksoacidov, katerih kemijska formula je H2S2Tudi7. Formula izrecno kaže, da obstajata dva atoma žvepla, in kot tudi njeno ime tudi poudarja, morata biti dve H molekuli2SW4 samo en; Vendar je namesto osmih sedem kisika, zato mora imeti žveplo tri.
Ta kislina je kot ena glavnih sestavnih delov olja (ali dimne žveplove kisline), ki postane "gosta" oblika žveplove kisline. Takšna je njihova prevlada, ki jo nekateri menijo, da je olje kot sinonim za disulfrinsko kislino; ki je znano tudi po tradicionalnem imenu pirosulfurinske kisline.
Na sliki je prikazan prejemnik z oljem, s koncentracijo žveplovega trioksida, torej3, 20 %. Za to snov je značilno, da je mastna in brezbarvna; čeprav lahko rumenkasto ali rjavo postane rumeno, odvisno od koncentracije SO3 in prisotnosti nekaterih nečistoč.
Zgoraj pripoveduje sodelovanje SO3 v h2S2Tudi7; to je h molekula2SW4 Reagirati z enim od SO3 Tvoriti disulfrinsko kislino. Biti takrat, h2S2Tudi7 Lahko ga zapišemo tudi kot h2SW4· SW3.
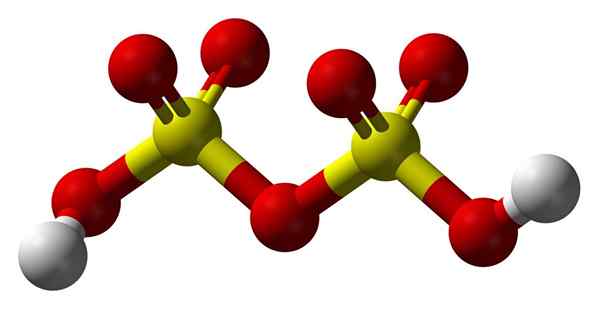
Struktura disulfrinske kisline
 Struktura disulfrinske kisline
Struktura disulfrinske kisline Gor2S2Tudi7 V modelu sfer in palic. Upoštevajte simetrijo molekule: leva stran kisikovega mostu je enaka desni. S tega vidika lahko strukturo opišemo s formulo3Blag3H.
Na obeh koncih je vsaka hidroksilna skupina, katere vodik z induktivnim učinkom vseh teh kisikovih atomov poveča njegovo pozitivno delno obremenitev; In posledično ima disulfrinska kislina še močnejšo kislost kot žveplova kislina.
Vam lahko služi: kalijev hidroksid: struktura, lastnosti, uporabeMolekulo lahko zapišemo kot h2SW4· SW3. Vendar se to bolj nanaša na sestavo oleja kot na strukturo molekule.
Če pa dodamo molekulo vode2S2Tudi7, Izpuščeni bosta dve molekuli2SW4:
H2S2Tudi7 + H2Ali 2h2SW4
Ravnotežje se lahko premakne na levo: na tvorbo h2S2Tudi7 Iz h2SW4 Če je dobavljena toplota. Iz tega razloga je H2S2Tudi7 Znana je tudi kot pirosulfurinska kislina; Ker se lahko ustvari po segrevanju žveplove kisline.
Tudi, kot je bilo omenjeno na začetku, h2S2Tudi7 Tvori ga neposredna kombinacija h2SW4 In tako3:
SW3 + H2SW4 H2S2Tudi7
Lastnosti
 Oleum. Vir: w. Oelen [cc by-sa 3.0 (https: // creativeCommons.Org/licence/by-sa/3.0)], prek Wikimedia Commons
Oleum. Vir: w. Oelen [cc by-sa 3.0 (https: // creativeCommons.Org/licence/by-sa/3.0)], prek Wikimedia Commons Lastnosti disulfurinske kisline niso zelo dobro opredeljene, saj je izjemno težko izolirati izključno iz olja.
Ne pozabite, da so v olju lahko druge spojine, s h h2SW4· XSO3, kjer ima lahko celo polimerne strukture, odvisno od vrednosti x.
Eden od načinov za vizualizacijo je predstavljati, da je zgornja struktura H2S2Tudi7 postane bolj podolgovat z več enotami3 in kisikove mostove.
V skoraj čistem stanju je sestavljen iz nestabilne kristalne trdne snovi (kajenje), ki se topi pri 36 ° C. Vendar se ta tališča lahko razlikuje glede na resnično sestavo.
Disulfrinska kislina lahko tvori tisto, kar je znano kot disulfate (ali pirosulfat). Na primer, če reagirate s kalijevim hidroksidom, tvorite kalijev pirosulfat, k2S2Tudi7.
Poleg tega lahko komentiramo, da ima molekulsko maso 178 g/mol in dva kisla enakovredna (2 uri iona+ ki jih je mogoče nevtralizirati z močno osnovo).
Vam lahko služi: hlapnostReakcija dehidracije sladkorja
S to spojino v obliki olja je mogoče izvesti radovedno reakcijo: transformacija grudic ogljikovih blokov.
H2S2Tudi7 Reagira s sladkorji, ki odpravljajo vse njegove skupine OH v obliki vode, ki daje prednost novim sindikatom med ogljikovimi atomi; sindikati, ki na koncu povzročijo črni premog.
Nomenklatura
Disulfrinska kislina velja za anhidrid žveplove kisline; To pomeni, da izgubi molekul vodne molekule kondenzacije med dvema kislinskima molekulama. Pred toliko možnimi imeni za to spojino, nomenklatura IUPAC preprosto priporoča, da je disulfrinska kislina.
Izraz "piro" aludira izključno na tisti, ki se oblikuje kot produkt uporabe toplote. Iupac tega imena ne svetuje za h2S2Tudi7; Vendar ga še vedno uporabljajo številni kemiki.
Prekinitev -ico ostaja nespremenljiv, saj atom žvepla še naprej ohranja valenco +6. Na primer, izračunajte ga z naslednjim aritmetičnim delovanjem:
2H + 2s + 7o = 0
2 (+1) + 2s + 7 (-2) = 0
S = 6
Prijave
Shrani žveplovo kislino
Disulfrinska kislina, glede na svojo lastnost, da se utrdi kot olje, se lahko raztaplja in hrani. To je zato, ker SO3 pobegne v ustvarjanje neprekinjene "megle", ki je v H veliko bolj topna2SW4 kot v vodi. Pridobiti h2SW4, Dovolj bi bilo dodati vodnega olja:
H2S2Tudi7 + H2Ali 2h2SW4
100% sinteza žveplove kisline
Iz prejšnje enačbe h2SW4 Razredčen je v dodani vodi. Na primer, če imate vodno raztopino H2SW4, Kjer je SO3 Nagiba se, da pobegne in predstavlja tveganje za delavce, dodaja olje v raztopino, ki reagira z vodo, ki tvori več žveplove kisline; to pomeni povečanje njegove koncentracije.
Lahko vam služi: kemična neprepustnostČe je ostala voda, se doda več3, ki reagira s h2SW4 da nastane več disulfrinske kisline ali olja, nato pa hidrira "sušenje" h2SW4. Postopek ponovi včasih dovolj, da dobi žveplovo kislino pri 100 -odstotni koncentraciji.
Podoben postopek se uporablja za pridobivanje 100% dušikove kisline. Prav tako se uporablja za dehidriranje drugih kemičnih snovi, ki se uporabljajo za eksplozivno izdelavo.
Sulfonacija
Strukture, kot so barvila; to pomeni, da dodate skupine -tako3H, ki ga izgubi kisli proton, lahko zasidrate na polimer tekstilnih vlaken.
Po drugi strani se kislost oleuma uporablja za doseganje druge nitracije (dodajte skupine -ne2) do aromatičnih obročev.
Reference
- Anorganska kemija. (Četrta izdaja). MC Graw Hill.
- Pirosulfurinska kislina. Okrevano od: pubchem.NCBI.NLM.ameriški nacionalni inštitut za zdravje.Gov

