Struktura kromične kisline, lastnosti, pridobivanje, uporabe

- 3000
- 215
- Miguel Gutmann DVM
On kromova kislina ali h2Cro4 Kislina, povezana s kromijevim oksidom (VI) ali kromnim oksidom, je teoretično3. To poimenovanje je posledica dejstva, da v kislih vodnih raztopinah kromovega oksida vrste h2Cro4 Prisotna je z drugimi vrstami kroma (VI).
Kromni oksid3 Imenuje se tudi brezvodna kromna kislina. Cro3 To je rdečkasta ali vijolično rjava trdna snov, ki jo dobimo pri zdravljenju raztopin kalijevega dikromata k2Cr2Tudi7 Z žveplovo kislino h2SW4.
 Cromski oksid zdrobi3 V talilnem loncu. Rando Tuikene [CC BY-SA 4.0 (https: // creativeCommons.Org/licence/by-sa/4.0)]. Vir: Wikipedia Commons.
Cromski oksid zdrobi3 V talilnem loncu. Rando Tuikene [CC BY-SA 4.0 (https: // creativeCommons.Org/licence/by-sa/4.0)]. Vir: Wikipedia Commons. Raztopine vodnih kromičnih oksidov imajo ravnovesje nekaterih kemičnih vrst, katerih koncentracija je odvisna od pH raztopine. Osnovni pH prevladujejo kromatni ioni CRO42-, Medtem ko prevladujejo ioni hcro kisline4- in cr dicromato2Tudi72-. Ocenjuje se, da je kisla kislina prisotna tudi kromova kislina H2Cro4.
Zaradi svoje velike oksidacijske moči se v organski kemiji uporabljajo raztopine kromične kisline za izvajanje oksidacijskih reakcij. Uporabljajo se tudi v elektrokemičnih procesih za zdravljenje kovin, tako da pridobijo odpornost proti koroziji in obrabi.
Nekateri polimerni materiali se zdravijo tudi s kromovo kislino, da izboljšajo njihovo oprijem s kovinami, slikami in drugimi snovmi.
Raztopine kromične kisline so zelo nevarne tako za ljudi kot za večino živali kot za okolje. Zaradi tega se tekoči ali trdni postopki odpadki, pri katerih se uporablja kromova kislina.
[TOC]
Struktura
Molekula kromove kisline h2Cro4 Nastane ga Cromato Cro ion42- in dva vodikova iona h+ Združen s tem. V kromatnem ionu je element kroma v stanju +6 oksidacije.
Prostorska struktura kromatnega iona je tetraedra, kjer je krom v središču in kisik zaseda štiri točke tetraedrona.
V kromični kislini so atomi vodika vsak poleg kisika. Od štirih kromijskih vezi z atomi kisika sta dve dvojni in dve preprosti, saj imata hidrogene združene.
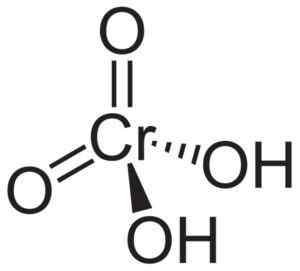 Struktura kromove kisline h2Cro4 kjer opazimo tetraedrsko obliko kromata in njegove dvojne vezi. Neuroteker [javna domena]. Vir: Wikipedia Commons.
Struktura kromove kisline h2Cro4 kjer opazimo tetraedrsko obliko kromata in njegove dvojne vezi. Neuroteker [javna domena]. Vir: Wikipedia Commons. Po drugi strani pa CRO -CCOOMIN OXID3 Ima oksidacijski krom atom +6, obkrožen s samo tremi atomi kisika.
Nomenklatura
- Kromna kislina h2Cro4
- Tetraoksohromna kislina h2Cro4
- Kromni oksid (brezvodna kromna kislina) CRO3
- Kromijev trioksid (brezvodna kromna kislina) CRO3
Lastnosti
Fizično stanje
Anhidro ali kromova oksidna kromna kislina je kristalna trdna snov vijolične do rdeče
Molekularna teža
Cro3: 118,01 g/mol
Tališče
Cro3: 196 ° C
Nad njegovo tališče je toplotno nestabilno, izgubi kisik (zmanjša se), da da krom oksid (III) Cr2Tudi3. Razpade pri približno 250 ° C.
Gostota
Cro3: 1,67-2,82 g/cm3
Topnost
Cro3 V vodi je zelo topen: 169 g/100 g vode pri 25 ° C.
Topno je v mineralnih kislinah, kot sta žveplo in dušik. Alkohol topen.
Druge lastnosti
Cro3 Je zelo higroskopsko, njeni kristali so okusni.
Ko kro3 Raztopi v vodi močno kisle rešitve.
Vam lahko služi: Titanium: Zgodovina, struktura, lastnosti, reakcije, uporabeJe zelo močan oksidant. Oxy močno organska snov v skoraj vseh oblikah. Napada tkanino, usnje in nekaj plastike. Večina kovin tudi napade.
Je močno strupena in zelo draži zaradi velikega oksidacijskega potenciala.
Kemija vodnih raztopin, kjer je prisotna kromova kislina
Kromni oksid3 Hitro se raztopi v vodi. V vodni raztopini lahko krom (VI) obstaja v različnih ionskih oblikah.
PH> 6,5 ali v alkalni raztopini krom (vi) pridobi obliko cromato ionov42- rumena.
Če se pH zmanjša (1 < pH < 6,5) el cromo (VI) forma principalmente el ion HCrO4- , ki se lahko dimerizira na ion dicromato cr2Tudi72-, In rešitev postane oranžna. Pri pH med 2,5 in 5,5 prevladujoča vrsta hcro4- in cr2Tudi72-.
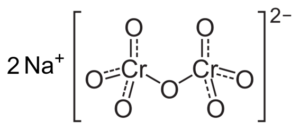 CR dikromat ionska struktura2Tudi72- ki je poleg dveh ionov natrijevega NA+. Kapacit [cc by-sa 3.0 (https: // creativeCommons.Org/licence/by-sa/3.0)]. Vir: Wikipedia Commons.
CR dikromat ionska struktura2Tudi72- ki je poleg dveh ionov natrijevega NA+. Kapacit [cc by-sa 3.0 (https: // creativeCommons.Org/licence/by-sa/3.0)]. Vir: Wikipedia Commons. Stanja, ki se pojavijo v teh rešitvah, ko se pH zmanjša, so naslednja:
Cro42- (kromat ion) + h+ ⇔ hcro4-
Hcro4- + H+ ⇔ h2Cro4 (kromova kislina)
2HCRO4- ⇔ cr2Tudi72- (Dikromat ion) + h2Tudi
Ta stanja se pojavijo le, če je kislina, ki je dodana za znižanje pH3 ali hclo4, Ker se z drugimi kislinami tvorijo različne spojine.
Kisle raztopine dikromata so zelo energična oksidacijska sredstva. Toda v alkalnih raztopinah je kromatni ion veliko manj oksidanta.
Pridobivanje
Glede na posvetovane vire, eden od načinov za pridobitev crom cromsko oksid3, To je sestavljeno iz dodajanja žveplove kisline vodni raztopini natrijevega ali kalijevega dikromata, ki tvori rdeče-oranžno oborino.
 Kromni oksid hidrirana ali kromična kislina. Himstakan [cc by-sa 4.0 (https: // creativeCommons.Org/licence/by-sa/4.0)]. Vir: Wikipedia Commons.
Kromni oksid hidrirana ali kromična kislina. Himstakan [cc by-sa 4.0 (https: // creativeCommons.Org/licence/by-sa/4.0)]. Vir: Wikipedia Commons. Kromna kislina h2Cro4 Najdemo ga v vodnih raztopinah kromičnega oksida v kislem mediju.
Uporaba kromične kisline
Pri oksidaciji kemičnih spojin
Zaradi svoje močno oksidacijske sposobnosti se kromova kislina že dolgo uporablja in uspešno oksidira organske in anorganske spojine.
Med neštetimi primeri je naslednje: omogoča oksidacijo primarnih alkoholov aldehido in te karboksilne kisline, alkoholi, ki so sekundarni ketoni, toluen do benzoinske kisline, etilbenzen do acetofenona, trifenilmetano do trifenilkarbinola, FO -CO -CO -CO -2, Oksalna kislina do co2, mlečna kislina do acetaldehida in co2, Železna vera2+ Vera železove vere3+, Ion jodid do joda itd.
Omogoča pretvorbo dušikovih kompenzivnih v dušike, sulfide v sulfone. Vmešava v sintezo ketonov, ki temeljijo na alkenih, saj je oksidiral hidroobrejene alkene do ketonov.
Spojine zelo odporne na običajne oksidante, kot je kisik oz2 ali vodikov peroksid h2Tudi2, Oksidira jih s kromovo kislino. To je primer nekaterih heterocikličnih bastes.
V procesih anodizacije kovin
Anodizacija kromične kisline je elektrokemična obdelava, ki velja za aluminij, da ga dolga leta zaščiti pred oksidacijo, korozijo in obrabo.
Proces anodizacije vključuje elektrokemično tvorbo plasti aluminijevega oksida ali glinice na kovini. Ta plast se nato zapre v vročo vodo, kar dosežemo s pretvorbo v trihidriran aluminijev oksid.
Zatesnjena oksidna plast je debela, vendar je strukturno šibka in ni zelo zadovoljiva za kasnejše lepilne sindikate. Vendar pa z dodajanjem majhne količine kromove kisline za tesnjenje vode razvije površina, ki lahko tvori dobre vezi.
Vam lahko služi: zakon o ohranjanju snoviKromna kislina v tesnjenju vode raztopi del debele celične strukture in pušča tanko, močno, trdno pritrjeno na aluminijev oksid, na katerega se lepila držijo in tvorijo močne in trajne sklepe.
Anodizacija s kromovo kislino velja tudi za titan in njegove zlitine.
Pri kemični pretvorbi
Kromna kislina se v procesih kovinske prevleke uporablja s kemično pretvorbo.
Med tem postopkom se kovine potopijo v raztopine kromične kisline. To reagira in delno raztopi površino, ki hkrati odlaga tanko plast kompleksnih kromijskih spojin, ki delujejo z osnovno kovino.
Ta postopek se imenuje Chromatova pretvorba ali pretvorba kroma.
Kovine, ki so na splošno podvržene pretvorbenemu kromu, so različne vrste jekla, kot so ogljikovo jeklo, nerjavno jeklo in jeklo, obloženo mangan in srebro.
Ta obdelava zagotavlja korozijo in odpornost na kovino. Višji pH procesa večja odpornost proti koroziji. Temperatura pospešuje kislinsko reakcijo.
Nanesemo prevleko različnih barv, na primer modro, črno, zlato, rumeno in prozorno. Omogoča tudi boljše spoštovanje kovinske površine proti slikam in lepilom.
V erodirani ali sesekljani površini
Raztopine kromične kisline se uporabljajo pri pripravi površine termoplastičnega materiala, termozastičnih polimerov in elastomerov za kasnejši premaz s slikami ali lepili.
H2Cro4 doseže vpliv na površinsko kemijo in njegovo strukturo, saj pomaga povečati svojo hrapavost. Kombinacija ugrizov in oksidacije poveča prodor lepil in lahko celo povzroči spremembe v lastnostih polimera.
Uporablja se za erodiranje razvejenega polietilena nizke gostote, visoke gostote in polipropilenskega linearnega polietilena.
Veliko se uporablja v industriji elektro-receipt ali galvanoplastike.
V več uporabi
Kromna kislina se uporablja kot leseni konzervans, tudi pri magnetnih materialih in za kemične reakcije Kataliza.
Obnovitev kromne kisline
Obstaja veliko procesov, ki uporabljajo kromovo kislino in ustvarjajo tokove ali ostanke, ki vsebujejo krom (III), ki jih ni mogoče zavreči, ker imajo kromirane ione (vi), ki so zelo strupeni, ali ponovno uporabijo, ker je koncentracija kromatnih ionov zelo nizka.
Njegova razporeditev zahteva kemično zmanjšanje kromatov na krom (III), sledi padavinja hidroksida in filtracije, kar ustvarja dodatne stroške.
Zaradi tega so bile preučene različne metode za odstranjevanje in obnovo kromatov. Tu je nekaj teh.
Skozi uporabo smol
Dolga leta se uporabljajo smole za izmenjavo ionov za čiščenje vode, onesnažene z krom,. To je eno od zdravljenja, ki ga je odobrila ameriška agencija za varstvo okolja ali EPA (kratica za angleščino Agencija za varstvo okolja).
Ta metoda omogoča obnovitev koncentrirane kromične kisline, saj se ponovno regenerira iz smole.
Smole so lahko močne ali šibke baze. V močno osnovnih smolah lahko kromat odstranite kot hcro ioni4- in cr2Tudi72- Izmenjajo se z OH ioni- in Cl-. V šibko osnovnih smolah, na primer sulfat, se ioni izmenjujejo s SOS42-.
Vam lahko služi: nepelometrijaV primeru močno osnovnih smol R- (OH) so globalne reakcije naslednje:
2ROH + HCRO4- + H+ ⇔ r2Cro4 + 2H2Tudi
R2Cro4 + 2HCRO4- ⇔ 2rhcro4 + Cro42-
R2Cro4 + Hcro4- + H+ ⇔ r2Cr2Tudi7 + H2Tudi
Za vsak mol r2Cro4 Pretvorba enega mola Cr (VI) raztopine se odstrani, zaradi česar je ta metoda zelo privlačna.
Po odstranitvi kromatov smo smolo obdelamo z močno alkalno raztopino, da jih regenerira na varnem mestu. Nato se kromate pretvori v koncentrirano kromovo kislino, da se ponovno uporabi.
Skozi elektrokemično regeneracijo
Druga metoda je elektrokemična regeneracija kromične kisline, ki je tudi zelo priročna alternativa. Skozi ta postopek se krom (III) oksidalno oksidira v krom (vi). Anodni material v teh primerih je prednostno svinčen dioksid.
Uporaba mikroorganizmov za čiščenje odtokov s kromovo kislino
Metoda, ki je bila raziskana in se še vedno preučuje, je uporaba mikroorganizmov, ki so naravno prisotni v nekaterih odpadnih vodencah, onesnaženih s šesterokotnimi kromiranimi ioni.
 Škodljivi odtoki za okolje. Avtor: OpenCLIPART-VEKTORJI. Vir: Pixabay.
Škodljivi odtoki za okolje. Avtor: OpenCLIPART-VEKTORJI. Vir: Pixabay. Takšen je primer nekaterih bakterij, ki so prisotne v vodah odpadne vode. Ti mikrobi so preučevali in ugotovili, da so odporni na kromate in so sposobni tudi zmanjšati krom (vi) na krom (iii), kar je veliko manj škodljivo za okolje in živa bitja.
Zaradi tega se ocenjuje, da jih je mogoče uporabiti kot okolju prijazna metoda za sanacijo in razstrupljanje odpadnih vod, onesnaženih s kromovo kislino.
Tveganja kromove kisline in kromični oksid
Cro3 Ni gorivo, ampak lahko okrepi zgorevanje drugih snovi. Veliko vaših reakcij lahko povzroči požar ali eksplozijo.
Cro3 Raztopine kromične kisline so močna dražilna koža (lahko povzročijo dermatitis), oči (lahko jih zažgejo) in sluznice (lahko povzroči bronhazmo) in lahko povzročijo tako imenovane "kromirane votline" v dihalnem sistemu.
Kromirane spojine (VI), kot sta kromova kislina in kromni oksid.
Reference
- Bombaž, f. Albert in Wilkinson, Geoffrey. (1980). Napredna anorganska kemija. Četrta izdaja. John Wiley & Sons.
- Ali.S. Nacionalna knjižnica medicine. (2019). Kromova kislina. Okrevano od: pubchem.NCBI.NLM.ameriški nacionalni inštitut za zdravje.Gov
- Wegman, r.F. in van Twisk, j. (2013). Aluminijaste in aluminijeve zlitine. 2.5. Proces anodiziranja kromične kisline. V tehnikah pripravljanja površin za lepljenje lepila (druga izdaja). Okrevano od Scientirect.com.
- Wegman, r.F. in van Twisk, j. (2013). Magnezij. 6.4. Priprava magnezijevih in magnezijevih zlitin s postopki čiščenja kromične kisline. V tehnikah pripravljanja površin za lepljenje lepila (druga izdaja). Okrevano od Scientirect.com.
- Grot, w. (2011). Prijave. 5.1.8. Regeneracija kromične kisline. V fluoriranih ionomerih (druga izdaja). Okrevano od Scientirect.com.
- Swift, k.G. in Booker, J.D. (2013). Proces površinskega inženiringa. 9.7. Kromatiranje. Pri priročniku za izbiro proizvodnih procesov. Okrevano od Scientirect.com.
- Poulson, a.H.C. et al. (2019). Tehnike spreminjanja površin PEEK, vključno s plazemsko površinsko obdelavo. enajst.3.2.1. Površinsko jedkanje. V priročniku Peek Biomaterials (druga izdaja). Okrevano od Scientirect.com.
- Westheimer, f.H. (1949). Mehanizmi oksidacij kromove kisline. Kemični pregledi 1949, 45, 3, 419–451. Okrevani iz lokalov.Acs.org.
- Tan, h.K.S. (1999). Remival kromove kisline z izmenjavo aniona. Kanadski časopis za kemijsko inženirstvo, letnik 77, februar 1999. Pridobljeno iz spletne knjižnice.Wiley.com.
- Kabir, m.M. et al. (2018). Izolacija in karakterizacija bakterij, ki zmanjšujejo krom (VI), iz odtokov in trdnih odpadkov. World Journal of Microbiology and Biotechnology (2018) 34: 126. NCBI si je opomogel.NLM.ameriški nacionalni inštitut za zdravje.Gov.
- « Značilnosti, elementi in primeri industrijske krajine
- Molekularna struktura cianhidrična kislina, lastnosti, uporablja »

