Molekularna struktura cianhidrična kislina, lastnosti, uporablja

- 1184
- 62
- Percy Feeney
On hidrocianska kislina O vodikov cianid je organska spojina, katere kemijska formula je HCN. Znan je tudi kot metanonitril.
Cianhidrična kislina je brezbarven, izjemno strupen plin, ki ga dobimo pri zdravljenju cianidov s kislinami. Ta kislina se nahaja v grahovem semenu, ki je na mnogih mestih znana tudi kot breskev.
 Breskev seme, ki vsebuje vodikov cianid ali vodikov cianid, HCN. An.Ha [cc by-sa 3.0 (https: // creativeCommons.Org/licence/by-sa/3.0)]. Vir: Wikipedia Commons.
Breskev seme, ki vsebuje vodikov cianid ali vodikov cianid, HCN. An.Ha [cc by-sa 3.0 (https: // creativeCommons.Org/licence/by-sa/3.0)]. Vir: Wikipedia Commons. Pri temperaturi okolice je manjša od 25 ° C tekočina in nad tem je temperatura plin. V obeh primerih je izjemno strupen za človeka, živali in celo večino mikroorganizmov, ki niso aklimatizirani nanj. To je dobro topilo za ione. Je zelo nestabilen, ker se ponavadi zlahka polimerizira.
Najdemo ga v zelenjavnem kraljestvu, vgrajenem v molekule nekaterih glukozidov, ker ko jih hidrolizirajo z encimi zelenjave, dobimo HCN, glukozo in benzaldehid.
Ti glukozidi so znotraj semen nekaterih sadja, kot so breskve, marelice, češnje, slive in v grenkih mandljih, zato jih nikoli ne bi smeli zaužiti.
Najdemo ga tudi v rastlinah, kot so nekatere vrste sirka. Poleg tega jih nekatere bakterije proizvajajo med presnovo. Večinoma se uporablja v proizvodnji polimerov in v nekaterih metalurških procesih.
HCN je smrtonosni strup zaradi vdihavanja, zaužitja in stika. Prisoten je v dimu cigarete in v dimu ognja plastike in materialov, ki vsebujejo ogljik in dušik. Šteje se, da se onesnaževalo zraka pojavi med zgorevanjem organskega materiala z obsežnih območij planeta.
[TOC]
Molekularna struktura in elektronska konfiguracija
Vodikov cianid ali cianidna kislina je kovalentna, molekularna spojina, z atomom vodika, ogljikom in ena od dušika.
Atom ogljika in dušika imata 3 pare elektronov, zato tvorijo trojno povezavo. Vodik je povezan z ogljikom, ki s to zvezo predstavlja svojo Valencia de Cuatro in svoj celotni elektronski oktet.
Dušik predstavlja pet Valencije pet, za dokončanje okteta pa ima par izginotnih ali osamljenih elektronov, ki se nahajajo na bočno.
HCN je torej popolnoma linearna molekula, z nekaj manjkajočimi elektroni, nameščenimi bočno v dušiku.
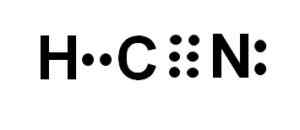 Lewisova predstavitev cianhidrične kisline, kjer so opazili elektrone, ki jih delijo v vsaki vezi in par osamljenih dušikovih elektronov. Avtor: Marilú Stea.
Lewisova predstavitev cianhidrične kisline, kjer so opazili elektrone, ki jih delijo v vsaki vezi in par osamljenih dušikovih elektronov. Avtor: Marilú Stea. 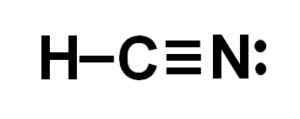 Struktura vodikovega cianida ali vodikovega cianida, kjer opazimo trojno vez med ogljikom in dušikom. Avtor: Marilú Stea.
Struktura vodikovega cianida ali vodikovega cianida, kjer opazimo trojno vez med ogljikom in dušikom. Avtor: Marilú Stea. Nomenklatura
- Hidrocianska kislina
- Vodikov cianid
- Metanonitril
- Formonitrile
- Hidrocianska kislina
Lastnosti
Fizično stanje
Pod 25,6 ° C, če je brezvodna in stabilizirana, je zelo nestabilna in strupena bledo modra tekočina ali modra. Če je zgoraj, je temperatura izjemno strupen brezbarven plin.
Molekularna teža
27,03 g/mol
Tališče
-13,28 ° C
Vrelišče
25,63 ° C (upoštevajte, da vre tik nad temperaturo okolice).
Plamenišče
-18 ° C (metoda zaprte skodelice)
Temperatura samousmernosti
538 ° C
Vam lahko služi: plinska kromatografijaGostota
0,6875 g/cm3 pri 20 ° C
Topnost
Popolnoma mešan z vodo, etilnim alkoholom in etilnim etrom.
Konstanta disociacije
K = 2,1 x 10-9
Pkdo = 9,2 (je zelo šibka kislina)
Nekatere kemijske lastnosti
HCN ima zelo visoko dielektrično konstanto (107 do 25 ° C). To je zato, ker so njihove molekule zelo polarne in so povezane z vodikovimi mostovi, kot v primeru vode H2Tudi.
Ker ima tako visoko dielektrično konstanto, se izkaže, da je HCN dobro ionizirajoče topilo.
Tekoči brezvodni HCN je zelo nestabilen, ponavadi se nasilno polimerizira. Da bi se temu izognili, se dodajo stabilizatorji kot majhen odstotek H2SW4.
V vodni raztopini in v prisotnosti amoniaka in visokotlačnega adenin oblike, spojina, ki je del DNK in RNA, torej biološko pomembna molekula.
Je zelo šibka kislina, saj je njegova ionizacijska konstanta zelo majhna, zato je le delno v vodi, ki daje cianidni anion CN-. Tvorijo soli z bazami, ne pa z karbonatom.
Njegove vodne raztopine, ki niso zaščitene pred svetlobo4.
V raztopini predstavlja šibek vonj mandljev.
Jedkost
Ker je šibka kislina, na splošno ni korozivna.
Vendar vodne raztopine HCN, ki vsebujejo žveplovo kislino kot stabilizator, močno napadajo jeklo pri temperaturah, večjih od 40 ° C, in nerjavečega jekla pri temperaturah, večjih od 80 ° C.
Poleg tega lahko HCN razredčene vodne raztopine povzročijo ogljikovo jeklo tudi pri sobni temperaturi.
Napadate lahko tudi nekatere vrste gume, plastike in premazov.
Lokacija v naravi
V rastlinskem kraljestvu je razmeroma obilen del glukozidov.
Na primer nastane iz tonzilina c6H5-Ch (-cn) -o-glikoza-glikoza, spojina, prisotna v grenkih mandljih. Tonzil je cianogeni beta-glukozid, saj, ko hidrolizira, tvori dve molekuli glukoze, enega od benzaldehida in enega od HCN. Encim, ki jih sprošča, je beta-glukoksidaza.
Tonzilo najdemo v semenih breskev, marelice, grenkih mandljih, češnjah in slivah.
Nekatere vrste rastlin sirka vsebujejo cianogeno glucóside, imenovano Durrina (to je p-hidroksi- (S) -Mandelonitrilo-beta-d-glukozid). To spojino lahko razgradimo z dvostopenjsko encimsko hidrolizo.
Prvič, encim Durrinosa, ki je endogena v sirških rastlinah hidroli z glukozo in p-hidroksi- (S) -Mandelonitrilo. Nato slednji hitro postane brezplačen HCN in p-hidroksibenzaldehid.
 Rastlina sirka z visoko vsebnostjo Durrine. Noben strojno berljiv avtor ni zagotovil. Je domneval Pethan (na podlagi zahtevkov za avtorske pravice). [CC BY-SA 3.0 (http: // creativeCommons.Org/licence/by-sa/3.0/]]. Vir: Wikipedia Commons.
Rastlina sirka z visoko vsebnostjo Durrine. Noben strojno berljiv avtor ni zagotovil. Je domneval Pethan (na podlagi zahtevkov za avtorske pravice). [CC BY-SA 3.0 (http: // creativeCommons.Org/licence/by-sa/3.0/]]. Vir: Wikipedia Commons. HCN je odgovoren za odpornost rastlin sirka proti škodljivcem in patogenom.
To pojasnjuje dejstvo, da imata Durrina in encim Durrinosa v teh rastlinah različne lokacije in prideta v stik le, ko se tkiva poškodujejo ali uničijo, sproščajo HCN in ščitijo rastlino okužb, ki bi lahko prodrli skozi poškodovano zabavo.
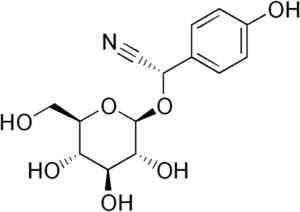 Molekula Durrina, kjer opazimo trojno CN vez, z encimsko hidrolizo proizvaja HCN. Edgar181 [javna domena]. Vir: Wikipedia Commons.
Molekula Durrina, kjer opazimo trojno CN vez, z encimsko hidrolizo proizvaja HCN. Edgar181 [javna domena]. Vir: Wikipedia Commons. Poleg tega nekatere patogene bakterije človeka, kot je Pseudomonas aeruginosa in Str. Gingivalis Proizvajajo ga med svojo presnovno aktivnostjo.
Prijave
Pri pripravi drugih kemičnih in polimernih spojin
Uporaba, ki vključuje večino HCN, ki se proizvaja na industrijski ravni, je priprava posrednikov za organsko sintezo.
Vam lahko služi: železov oksid (ii): struktura, nomenklatura, lastnosti, uporabeUporablja se v sintezi adiponitrila nc- (ch2)4-CN, ki se uporablja za pripravo najlona ali najlona, poliamida. Služi tudi za pripravo acrilonitrilo ali cianoetilen cho2= CH-CN, ki se uporablja za pripravo akrilnih in plastičnih vlaken.
Njegov derivacijski natrijev cianid se uporablja za obnovo zlata pri rudarjenju te kovine.
Drug od njegovih derivatov CLCN cianogen klorid služi za formule pesticidov.
HCN se uporablja za pripravo kelacijskih sredstev, kot je EDTA (Etilen-Diamino-Tetra-Acetato).
Služi za proizvodnjo ferocianidov in nekaj farmacevtskih izdelkov.
Različne uporabe
HCN plin je bil uporabljen kot insekticid, fungicid in razkužilo, za fumigacijo ladij in stavb. Tudi za odpiranje pohištva, da bi jih obnovili.
HCN se uporablja v kovinskem laku.
Za svojo zelo visoko strupenost je bil imenovan za kemijskega vojnega agenta.
V kmetijstvu
Uporablja se kot herbicid in pesticid v sadovnjakih. Uporabil je za nadzor lusk in drugih patogenov citrusov, vendar so nekateri od teh škodljivcev postali odporni na HCN.
Uporablja se tudi za fumigacijo silosov zrn. Plinasti HCN, pripravljen na mestu. Pri tej uporabi je nujno, da se semena zavarujejo s sredstvom za pesticide.
Testirajoča semena pšenice so bila narejena s HCN in ugotovljeno je, da potencial kalitve teh ne vpliva negativno, temveč se zdi.
Vendar lahko visoki odmerki HCN znatno zmanjšajo dolžino majhnih listov, ki poženejo iz semena.
Po drugi strani pa zaradi dejstva, da gre za močan nematicid in da ga imajo nekatere rastline sirka v svojih tkivih.
Njegova uporaba bi služila za izboljšanje tal, zatiranje plevela in nadzorovanje bolezni ter poškodbe, ki jih povzročajo fitoparazitske ogorčice.
Tveganja
Za človeka je HCN smrtonosni strup na vseh poteh: vdihavanje, zaužitje in stik.
 Avtor: Clker-brez vektorjev. Vir: Pixabay.
Avtor: Clker-brez vektorjev. Vir: Pixabay. Vdihavanje je lahko smrtonosno. Ocenjujejo, da lahko približno 60-70% populacije odkrije vonj grenkih hcn mandljev, ko je v zraku pri koncentraciji 1-5 ppm.
Vendar obstaja 20% populacije, ki ga še vedno ne more zaznati v smrtnih koncentracijah, ker tega genetsko ne morejo storiti.
Zaužitje je akutni in takojšnji akcijski strup.
Če vaše rešitve pridejo v stik s kožo, je povezan cianid lahko smrtonosen.
HCN je prisoten v cigaretnem dimu in tisti, ki nastane, ko plastike, ki vsebujejo dušik.
Smrtonosni akcijski mehanizem znotraj organizma
Je kemikalija in je hitro strupena, pogosto vodi v smrt. Ob vstopu v organizem se pridruži metaloencimom (encimi, ki vsebujejo kovinski ion), ki jih inaktivirajo. To je strupeno sredstvo za več organov človeškega telesa
Njegov glavni strupeni učinek je inhibicija celičnega dihanja, saj deaktivira encim, ki vpliva na fosforilacijo v mitohondrijih, ki so organele, ki med drugim posegajo v dihalno funkcijo celic.
Vam lahko postreže: kalijev permanganat (kmno4)Tveganje za cigaretni dim
HCN je prisoten v cigaretnem dimu.
Čeprav mnogi poznajo učinek zastrupitve HCN, le malo ljudi se zaveda, da so s cigaretnim dimom izpostavljeni svojemu škodljivemu učinku.
HCN je eden od vzrokov inhibicije več celičnih respiratornih encimov. Količina HCN, ki je prisotna v cigaretnem dimu, škodljivo vpliva na živčni sistem.
O ravni HCN so poročali v cigaretnem dimu med 10 in 400 μg na cigareto za dim neposredno in 0,006 do 0,27 µg/cigareto za sekundarno vdihavanje (pasivni kadilec). HCN proizvaja toksične učinke od 40 μm naprej.
 Avtor: Alexas fotografije. Vir: Pixabay.
Avtor: Alexas fotografije. Vir: Pixabay. Vdihni hitro vstopi v krvni obtok, kjer se sprošča v plazmi ali se veže na hemoglobin. Majhen del se pretvori v tiocianato in ga izloča urin.
HCN ogrevalna tveganja
Dolgotrajna izpostavljenost toploti tekočine HCN v zaprtih posodah lahko povzroči nasilno in nepričakovano rupturo. Lahko eksplozivno polimerizira 50-60 ° C v prisotnosti alkalijskih sledi in v odsotnosti zaviralcev.
Prisotnost hcn v požarnem dimu
HCN se sprosti med zgorevanjem polimerov, ki vsebujejo dušik, kot so volna, svila, poliakrilonitrilos in najlon. Ti materiali so prisotni v naših domovih in na večini krajev človeške dejavnosti.
Zaradi tega je HCN lahko vzrok smrti z vdihavanjem.
Onesnaževalo v atmosferi
HCN je onesnaževalo s troposfero. Je odporen na fotolizo in pod okoljskimi pogoji atmosfere ne trpi hidrolize.
OH hidroksilni radikali • Proizvajati fotokemično lahko reagirajo s HCN, vendar je reakcija zelo počasna, zato je polovico življenja HCN v atmosferi 2 leti.
Ko se opekli biomase, zlasti Mob, se HCN sprosti v ozračje in tudi med industrijskimi dejavnostmi. Vendar je zgorevanje šote od 5 do 10 -krat več onesnaževalnega kot kurjenje druge vrste biomase.
Nekateri raziskovalci so ugotovili, da visoke temperature in suša, ki jo povzroča pojav El Niño na nekaterih območjih planeta.
 Avtor: Steve Buissinne. Vir: Pixabay.
Avtor: Steve Buissinne. Vir: Pixabay. To vodi do močnega opeklina biomase v suhih postajah.
Ti dogodki so vir visokih koncentracij HCN v troposferi, ki se sčasoma prepeljejo na nizko stratosfero in ostanejo zelo dolgo.
Reference
- Bombaž, f. Albert in Wilkinson, Geoffrey. (1980). Napredna anorganska kemija. Četrta izdaja. John Wiley & Sons.
- Ali.S. Nacionalna knjižnica medicine. (2019). Vodikov cianid. Okrevano od PubChema.NCBI.NLM.ameriški nacionalni inštitut za zdravje.Gov.
- Gidlow, d. (2017). Posodobitev vodika cianida-posodobitev. Delavna medicina 2017; 67: 662-663. NCBI si je opomogel.NLM.ameriški nacionalni inštitut za zdravje.Gov.
- Znanstvena enciklopedija Van Nostranda. (2005). Vodikov cianid. 9th Pridobljeno iz spletne knjižnice.Wiley.com.
- Ren in.-L. et al. (devetnajst devetdeset šest). Vpliv vodikovega cianida in karbonilnega sulfida na kalitev in plumule pšenice. Pestična. Sci. 1996, 47, 1-5. Pridobljeno iz spletne knjižnice.Wiley.com.
- Iz Nicole, g.R. et al. (2011). Do preproste analitične metode za vrednotenje vsebnosti DHurrina v cianogenih rastlinah za njihovo uporabo pri krmi in biofofitaciji. J. Agric. Food Chem. 2011, 59, 8065-8069. Okrevani iz lokalov.Acs.org.
- Sheese, str.In. et al. (2017). Globalno izboljšanje vodikovega cianida v spodnji stratosferi do leta 2016. Geophys. Govedina. Lett., 44, 5791-5797. Okreval od Agupubs.Spletna knjižnica.Wiley.com.
- Surleva, a.R. in Drochioiu, g. (2013). Nevarnost vizualizacije kajenja: preprosta spektrofotometrična določitev vodikovega cianida v cigaretnem dimu in filtrih. J. Kem. Educa. 2013, 90, 1654-1657. Okrevani iz lokalov.Acs.org.
- Alarie in. et al. (1990). Vloga vodikovega cianida pri človeški smrti pri ognju. V ognju in polimeri. Poglavje 3. Serija ACS simpozija. Okrevani iz lokalov.Acs.org.

