Klorinska kislina (HClo3)
- 3044
- 96
- Raymond Moen
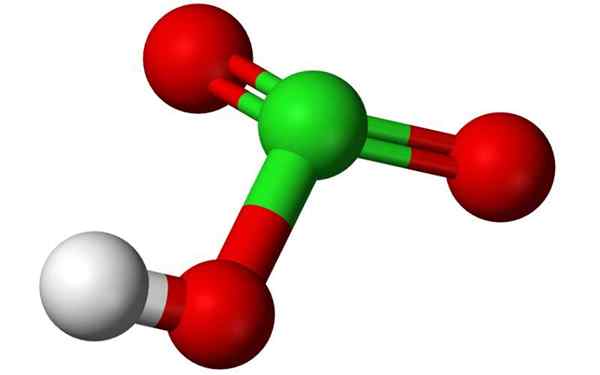
 Kemična struktura klorove kisline v 3D balonskem modelu. Vir: Benjah-BMM27, Wikimedia Commons
Kemična struktura klorove kisline v 3D balonskem modelu. Vir: Benjah-BMM27, Wikimedia Commons Kaj je klorova kislina?
On Klorožna kislina To je anorganska spojina formule HClo3, Oksacid klora in formalnega predhodnika kloratnih soli. Je močna kislina, ki lahko darova vodika sprejemniku ali baznem Tronstedu.
Spojino dobimo z barijevim kloratom (baritski klorat) z žveplovo kislino, da nastane barijev sulfat, voda netopna glede na naslednjo reakcijo:
Ba (clo3)2 + H2SW4 → 2HCLO3 + Baso4
Druga metoda pridobivanja je segrevanje hipoklorične kisline za pridobivanje kloro kisline in vodikovega klorida glede na reakcijo:
3HCLO → HCLO3 + 2HCl
Klorinska kislina (HCLO3) je močan oksidant, saj je sposoben zmanjšati stanja oksidacije +3, +1 in -1. Uporablja se za proizvodnjo kloratnih soli.
Razpade v koncentracije, večje od 30%. Prav tako se razgradi, ko se segreje, zato ga je treba ves čas hladiti, vse steklene kozarce.
Fizikalne in kemijske lastnosti
- Klorozna kislina obstaja samo v raztopini. Je brezbarvna tekočina brez značilne arome.
- Spojina ima molekulsko maso 84.459 g/mol in gostoto 1 g/ml pri 25 ° C.
- Ima vrelišče, večjo od 100 ° C, in topnost vode 40 g na 100 ml tega topila pri 25 ° C.
- Kloroška kislina bo pospešila kurjenje gorljivih materialov in lahko vklopi večino v stiku. Spojina je jedska za kovine in tkiva.
Vam lahko služi: soprecipitacijoSamoreaktivno
- Koncentracije klorove kisline nad 40% razpadejo.
- Antimon sulfid in koncentrirane raztopine klorične kisline reagirajo z žarinjem.
- Arzen sulfid in koncentrirane raztopine klororozne kisline reagirajo z žarinjem.
- Reagira z živahnostjo, celo eksplodira z drugimi kovinskimi sulfidi, to je bakreni sulfid.
- V stiku z oksidacijskimi materiali, vključno z amonijakom, so lahko reakcije izjemno nasilne.
- Filtrirni papir se vžge po potopitvi v klorovodikovo kislino.
- Eksplozije so bile zabeležene s klorično kislinsko raztopino s kovinami, kot so antimon, bizmut in železo. To je posledica tvorbe eksplozivnih spojin, vključno z vodikom.
Reaktivnost in nevarnosti
Kloroška kislina je nestabilna spojina. Ker je močna kislina, je izjemno nevarna v primeru stika s kožo (je jedko in dražilna), stik z očmi (draži) in v primeru zaužitja. Tudi to zelo nevarno v primeru vdihavanja.
Huda prekomerna izpostavljenost lahko povzroči poškodbe pljuč, zadušitev, izgubo znanja ali smrti. Dolgotrajna izpostavljenost lahko povzroči opekline in razjede kože.
Vdihavanje prekomerne izpostavljenosti lahko povzroči draženje dihal. Za vnetje očesa so značilne rdečice, namakanje in srbenje. Za vnetje kože je značilno srbenje, luščenje, pordelost in občasno nastajanje ampul.
Snov je strupena za ledvice, pljuča in sluznice. Ponavljajoča se ali dolgotrajna izpostavljenost snovi lahko povzroči škodo na teh organih.
V primeru očesnega stika morate preveriti, ali se kontaktne leče uporabljajo in jih takoj odstranite. Oči je treba vsaj 15 minut sprati s tekočo vodo, pri čemer so veke odprte. Lahko uporabimo hladno vodo. Ni treba uporabljati nobenih oči.
Vam lahko služi: acetonitrile (C2H3N)Če kemikalija pride v stik z oblačili, jo čim hitreje zadržite in zaščitite svoje roke in telo. Žrtev postavite pod varnostno prho.
Če se kemikalija nabira v izpostavljeni koži žrtve, kot so roke, se koža, onesnažena s tekočo vodo, in ne -Babrazivno milo mehko oprana in previdno.
Kislino lahko nevtralizirate tudi z razredčenim natrijevim hidroksidom ali s šibko osnovo, kot je natrijev bikarbonat. Če draženje traja, poiščite zdravniško pomoč. Oprajte onesnažena oblačila, preden ga ponovno uporabite.
Če je stik s kožo resen, ga je treba oprati z razkužilnim milom in pokrivati kožo, onesnaženo z antibakterijsko kremo.
V primeru vdihavanja je treba žrtev dovoliti, da stoji na dobro prezračenem območju. Če je vdihavanje resno, je treba žrtev čim prej evakuirati na varno območje.
Ohlapna tesna oblačila, kot so vrat srajce, pasovi ali kravata. Če je žrtev težko dihati, je treba dajati kisik. Če žrtev ne diha, je narejena oživljanje ust.
Upoštevati je treba, da je lahko nevarno za osebo, ki nudi pomoč pri oživljanju ust do ust, ko je vdihani material strupen, nalezljiv ali jedran.
V primeru zaužitja ne povzroča bruhanja. Ohlapna tesna oblačila, kot so vratovi srajce, pasovi ali kravate. Če žrtev ne diha, naredite oživljanje ust. V vseh primerih je treba iskati takojšnjo zdravniško pomoč.
Prijave
Klorenska kislina se uporablja predvsem za nastajanje kloratnih soli, kot so natrij, kalcij, magnezij, stroncij, svinca, bakro in srebro, pa tudi protokloreat in živo srebro se pripravimo z uporabo kloroga kisline kot reagenta kot reagent.
Vam lahko služi: encimska aktivnost: enota, meritev, regulacija in dejavnikiStabilni predhodnik klora dioksida se uporablja pri proizvodnji elektrokemije z visoko čistostjo amonija.
Glavna proizvodnja klorinske kisline se je začela med industrijsko revolucijo v Evropi in je bila uporabljena za proizvodnjo vinil klorida za PVC cevi.
Druga uporaba za kislino v številnih manjših aplikacijah, vključno z domačim čiščenjem, proizvodnjo želatine in drugimi aditivi za hrano, dekalcifikacijo in predelavo usnja.
Reference
- Klorične kisline.F.). Okreval od Weeblyja.com.
- Klorične kisline.F.). Okreval iz kemijske knjige.com.

