Klorovodikova kislina (HCl)

- 2173
- 359
- Ricky Dach
 Posoda s klorovodikovo kislino. Shuttersock
Posoda s klorovodikovo kislino. Shuttersock Kaj je klorovodikova kislina?
On klorovodikova kislina (HCl) ali muriatalna kislina je anorganska spojina, ki jo tvori raztopina v vodikovi kloridni vodi, kar povzroči hidronijev ion (H3Tudi+) in kloridni ion (Cl-). Natančneje, to je hidracija klorovega halogena z vodikom.
HCl je močna kislina, ki je popolnoma ionizirana v vodi, njeni ionizacijski produkti pa so stabilni. Celotna ionizacija HCl potrjuje dejstvo, da je pH 0,1 M raztopine HCl 1.
Glavna metoda za industrijsko proizvodnjo HCl je kloriranje organskih spojin za proizvodnjo, na primer diklorometan, trikloretilen, perloroetilen ali vinil klorid. HCl je stranski produkt reakcije kloriranja.
Uporablja se v osnovnih stopinjah v številnih kemičnih reakcijah, v kemični prebavi organskih spojin itd.
Hlapi klorovodikove kisline (vodikov klorid) lahko povzročijo resne lezije oči. Prav tako lahko povzročijo draženje in hude težave na dihalnih poteh.
Želodčna svetloba ima kislini pH (1-3) z visoko koncentracijo HCl. Prisotnost kisline daje prednost sterilizaciji vsebnosti želodca, ki inaktivira številne bakterije, ki so prisotne v hrani. To bi razložilo gastroenteritis, povezan s stanjem akroerhidrije.
Poleg tega HCL olajša prebavo beljakovin z aktiviranjem encima pepsina proteolitičnega delovanja.
Uporablja se pri čiščenju bazenov, običajno je običajno detergent, vendar obstajajo lise, ki se držijo med ploščicami, v teh primerih pa zahtevajo uporabo klorovodikove kisline.
Uporablja se pri nadzoru pH v farmacevtskih izdelkih, hrani in pitni vodi. Uporablja se tudi pri nevtralizaciji odpadnih tokov, ki vsebujejo alkalni material.
Klorovodikova kislina se uporablja pri regeneraciji ionskih izmenjav, ki se uporablja za ugrabitev kovinskih ionov ali drugih vrst ionov v industriji, v raziskovalnih laboratorijih in čiščenju pitne vode.
Po drugi strani pa lahko komentiramo tudi, da je vodikov klorid, plinasta spojina diatomska molekula in atomi, ki se tvorijo. Medtem je cloohidric kislina ionska spojina, ki se v vodni raztopini disociira v H+ in Cl-. Interakcija med temi ioni je elektrostatična.
Kemična struktura klorovodikove kisline
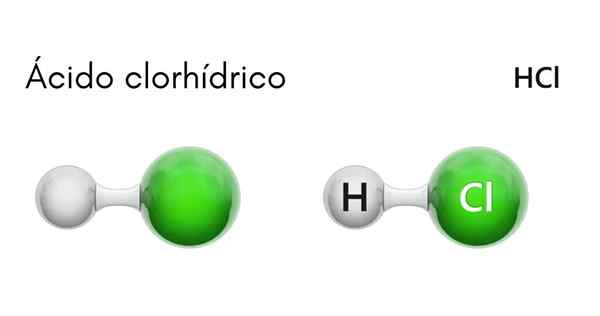
Vsaka molekula HCl tvori atom vodika in drugi klor. Čeprav je pri sobni temperaturi HCl strupen in brezbarven plin, če se raztopi v vodi, se pojavi klorovodikova kislina.
Tvorba klorovodikove kisline
-Lahko ga proizvaja elektroliza NaCl (natrijev klorid), ki povzroči h2 (G), Cl2 (g), 2. (AC) in OH- (AC). Nato:
H2 + Cl2 => 2 HCl
To je eksotermična reakcija.
-HCl se zgodi z reakcijo natrijevega klorida z žveplovo kislino. Postopek, ki ga je mogoče shematizirati na naslednji način:
NaCl +H2SW4 => Nahso4 + Hcl
Vam lahko služi: kisle soli (oksizale)Nato zbiramo vodikov klorid in natrijev klorid z natrijevim bisulfitom v skladu z naslednjo reakcijo reagira:
NaCl +nahso4 => Na2SW4 + Hcl
To reakcijo je v sedemnajstem stoletju uvedel Johan Glauber za proizvodnjo klorovodikove kisline. Trenutno se uporablja v laboratorijih, saj se je pomen njegove industrijske uporabe zmanjšal.
-Klorovodikova kislina se lahko proizvaja kot stranski produkt kloriranja organskih spojin, kot je: pri proizvodnji diklorometana.
C2H4 + Cl2 => C2H4Cl2
C2H4Cl2 => C2H3Cl +HCl
Ta metoda proizvodnje HCL se bolj industrijsko uporablja, izračuna, da je 90% HCL, proizvedenih v ZDA, s to metodologijo.
-In končno se HCL pojavi pri sežiganju kloriranih organskih odpadkov:
C4H6Cl2 + 5 o2 => 4 co2 + 2 h2O +2 HCl
Kje je klorovodikova kislina?
Klorovodikova kislina je koncentrirana v želodčni luči, kjer je dosežen pH 1. Obstoj pregrade sluzi, bogat z bikarbonatom, preprečuje, da bi želodčne celice poškodovale zaradi nizkega želodčnega pH.
Obstajajo trije glavni fiziološki dražljaji za izločanje H+ parietalne celice želodčnega telesa: želodca, histamin in acetilholin.
Želodca
Gastrin je hormon, ki se izloča v regiji želodčnega kluba, ki deluje s povečanjem medcelične koncentracije CA+ proti želodčni luči.
Aktivni transport opravi encim ATPay, ki porabi energijo, ki jo vsebuje ATP, za prevoz H+ proti želodčni luči in uvede k+.
Histamin
Izločajo ga tako imenovane celice, podobne enterokromofini (sec) želodčnega telesa. Njegovo delovanje je posredovano s povečanjem koncentracije cikličnega AMP in dejanj s povečanjem, pa tudi z želodcem, aktivnim prevozom H+ Proti želodčni svetlobi, ki jo posreduje črpalka H+-K+.
Acetilholin
Izločajo ga vagalni živčni terminali, pa tudi povprečna gastrina njegovo delovanje za povečanje medceličnega CA, ki aktivira delovanje črpalke H+-K+.
H+ parietalnih celic izvira iz reakcije CO2 s h2Ali oblikovati h2Co3 (ogljikova kislina). To je pozneje razčlenjeno na h+ in HCO3-. H+ Aktivno se prevaža do želodčne svetlobe skozi želodčno apikalno membrano. Medtem HCO3- Odpelje se v kri, povezano z vnosom CL-.
Mehanizem državnega udara proti protitransport ali protitransport-HCO3- ki se pojavlja v bazalni membrani parietalnih celic-. Nato se ion odpravi na želodčno svetlobo, ki spremlja h+. Ocenjujejo, da ima HCL želodčno izločanje koncentracijo 0,15 m.
Drugi biološki viri HCl
Obstajajo drugi dražljaji za izločanje HCl s parietalnimi celicami, kot sta kofein in alkohol.
Želodčna in dvanajstnika se pojavi, ko se pregrada prekine, ki ščiti želodčne celice pred škodljivim delovanjem HCL.
Vam lahko služi: cinkov sulfid (ZN)Z odpravo omenjenega zaščitnega delovanja bakterije Helicobacter pilori, Acetilsalicilna kislina in nesteroidni anti -vplavi (NSAID) prispevajo k proizvodnji razjed.
Izključitev kisline je kot odvisna od odstranjevanja mikrobov, ki so prisotni v hrani in sproži prebavo beljakovin, z delovanjem pepsina. Glavne celice želodčne telesne skrivnosti.
Fizikalne in kemijske lastnosti klorovodikove kisline
Molekularna teža
36.458 g/mol.
Barva
Je brezbarvna ali rahlo rumenkasta tekočina.
Vonj
To je dražilni vonj po hektarju.
Okus
Prag za degustacijo v čisti vodi je koncentracija 1,3 x 10-4 moli/l.
Vrelišče
-121 ° F A 760 mmHg. -85,05 ° C pri 760 mmHg.
Tališče
-174 ° F (-13,7 ° F) za raztopino HCl 39,7% P/P v vodi), -114,22 ° C.
Topnost vode
Raztopina HCL ima lahko 67% P/P A 86 ° F; 82,3 g/100 g vode pri 0 ° C; 67,3 g/100 g vode pri 30 ° C in 63,3 g/100 g vode pri 40 ° C.
Metanol topnost
51,3 g/100 g raztopine pri 0 ° C in 47 g/100 raztopine pri 20 ° C
Topnost etanola
41,0 /100 g raztopine pri 20 ° C
Eter topnost
24,9 G/100 raztopina pri 20 ° C.
Gostota
1.059 g/ml pri 59 ° F v 10,17 % raztopini P/P.
Gostota plina
1.00045 g/l
Gostota pare
1,268 (v zračnem razmerju, ki je vzet kot 1)
Parni tlak
32.452 mmHg pri 70ª F; 760 mmHg pri -120,6 ° F
Stabilnost
Ima visoko toplotno stabilnost.
Samosmernost
Ni vnetljivo.
Razgradnja
Razpade se s segrevanjem tako, da oddaja strupeni klor.
Viskoznost: 0,405 cpoise (tekočina pri 118,6 ° K), 0,0131 cpoise (para pri 273,06 ° K).
Jedkost
Je zelo jedko za aluminij, baker in nerjavno jeklo. Napada vse kovine (živo srebro, zlato, platina, srebro, tantalio, razen nekaterih zlitin).
Površinska napetost
23 mn/cm pri 118,6 ° K.
Polimerizacija
Aldehidi in epoksidi doživljajo nasilno polimerizacijo v prisotnosti klorovodikove kisline.
Na fizikalne lastnosti, kot so viskoznost, tlak na pari, vrelišče in tališče, vpliva odstotna koncentracija za HCl.
Uporaba klorovodikove kisline
Klorovodikova kislina ima številne namene doma, v različnih panogah, v učnih in raziskovalnih laboratorijih itd.
Industrijski in doma
-Klorovodikova kislina se uporablja pri hidrometalurški obdelavi, na primer pri proizvodnji glinice in titanovega dioksida. Uporablja se pri aktivaciji proizvodnje oljnih vrtin.
Vbrizgavanje kisline poveča poroznost okoli olja in tako daje prednost njegovi ekstrakciji.
-Uporablja se za odpravo nahajališč Caco3 (Kalcijev karbonat) s preoblikovanjem v COCL2 (kalcijev klorid), ki je bolj topen in ga je enostavno odpraviti. Prav tako se industrija uporablja pri predelavi jekla, materiala s številno uporabo in aplikacijami tako v panogah kot v konstrukcijah kot v domu.
-Mase uporabljajo rešitve HCl za pranje in čiščenje opek. Uporablja se doma v delu čiščenja in dezinfekcije kopalnic in njihovih odtokov. Poleg tega se pri graviranjih uporablja klorovodikova kislina, vključno z operacijami čiščenja kovin.
Vam lahko služi: toplotna: struktura, značilnosti, tvorba, primeri-Klorovodikova kislina se uporablja pri izločanju mohosovega železovega oksida.
Vera2Tudi3 + Fe +6 hcl => 3 FECL2 + H2Tudi
-Kljub temu, da je zelo koroziven.
Sinteza in kemijske reakcije
-Klorovodikova kislina se uporablja v reakcijah baze titracije ali alkalije, pa tudi v raztopini raztopine PH. Poleg tega se uporablja v številnih kemičnih reakcijah, na primer pri prebavi beljakovin, postopku pred vsebnostjo vsebnosti aminokislin in identifikacijo.
-Glavna uporaba klorovodikove kisline je proizvodnja organskih spojin, kot sta vinil klorid in diklorometan. Kislina je posrednik pri proizvodnji polikarbonatov, aktivnega oglja in askorbinske kisline.
-Uporablja se v proizvajalcih Pegas. Medtem ko se v tekstilni industriji uporablja pri beljenju tkanin. Uporablja se v usnjeni industriji, ki posega v svojo obdelavo. Prav tako se uporablja kot gnojilo in pri proizvodnji klorida, barvil itd. Uporablja se tudi v galvanoplastiki, v fotografiji in v gumijasti industriji.
-Uporablja se pri proizvodnji umetne svile, pri rafiniranju olj, maščob in mil. Poleg tega se uporablja pri reakcijah polimerizacije, izomerizacije in alkilacije.
Tveganja in strupenost klorovodikove kisline
Ima jedko delovanje na koži in sluznici, ki proizvajajo opekline. Te, če resne, lahko ustvarijo razjede, ki zapustijo keloidne in izvlečne brazgotine. Očesni stik lahko povzroči popolno zmanjšanje ali izgubo vida zaradi poškodbe roženice.
Ko kislina doseže obraz, lahko povzroči resne brazgotine, ki izkrivljajo obraz. Pogost stik s kislino lahko povzroči tudi dermatitis.
Zaužitje klorovodikove kisline povzroči opekline ust, grla, požiralnika in prebavil, kar povzroča slabost, bruhanje in drisko. V skrajnih primerih se lahko pojavi perforacija požiralnika in črevesja, s srčnim zastojem in smrtjo.
Po drugi strani lahko kisli hlapi, odvisno od njihove koncentracije, povzročijo draženje respiratornega trakta, kar povzroči faringitis, glottis edema, zoženje bronhijev z bronhitisom, cianozo in pljučnim edemom (prekomerno kopičenje tekočine v pljučih) in v skrajnem primeru) in v skrajnem primeru primeri, smrt.
Izpostavljenost visokim nivojem hlapov klorovodikove kisline lahko povzroči otekanje in krč v grlu s posledično zadušitvijo.
Zobna nekroza, ki se manifestira v zobeh, je pogosta tudi z izgubo njihove svetlosti; Se postanejo rumenkasto in mehki ter se končno zlomijo.
Reference
- Studenguy. (2018). Klorovodikova kislina (HCL): pomembna uporaba in aplikacije. Vzeto od: SturtiousGuy.com
- Ganong, w. F. (2003). Pregled medicinske fiziologije. Dvaindvajset izdaje. McGraw-Hill Companies Inc.
- Ctr. Varnostni list klorovodikove kisline. [PDF]. Vzeto od: UACJ.mx

