Karboksilna kislina
- 3527
- 549
- Mr. Shane Larkin
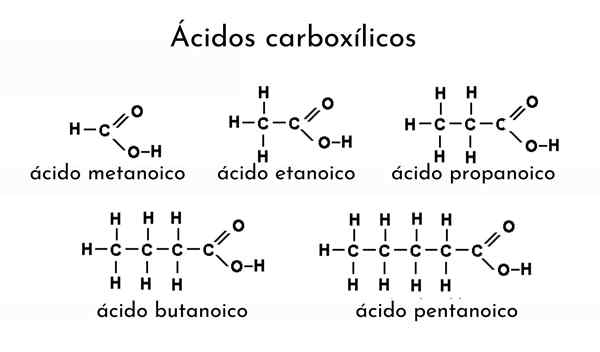
 Primeri karboksilnih kislin
Primeri karboksilnih kislin Kaj so karboksilne kisline?
On karboksilna kislina To je izraz, pripisan kateri koli organski spojini, ki vsebuje karboksilno skupino. Lahko jih imenujemo tudi organske kisline in so prisotni v mnogih naravnih virih. Na primer, iz mravelj in drugih žuželk, kot so galeritni hrošč, mravljična kislina, karboksilna kislina je destilirana.
To pomeni, da je mravljišče vir, bogat s mravljično kislino. Tudi ocetna kislina se ekstrahira iz kisa, vonj po rantidnem maslu je posledica matirne kisline, zelišča Valeria vsebujejo možgansko kislino in iz pokrovčkov, pridobljene s kaprikami, vse te karboksilne kisline.
Mlečna kislina daje slab okus kislega mleka, v nekaterih maščobah in oljih pa so prisotne maščobne kisline. Primeri naravnih virov karboksilnih kislin so nešteti, vendar vsa dodeljena imena izhajajo iz besed v latinščini. Tako v latinščini beseda formica pomeni "mrav".
Ker so bile te kisline izvlečene v različnih poglavjih zgodovine, so bila ta imena pogosta, konsolidirajo se v popularni kulturi.
Formula
The Splošna formula karboksilne kisline je -r -cooh, ali več podrobnosti: R- (c = o) -oh. Atom ogljika je povezan z dvema atoma kisika, kar povzroči zmanjšanje njegove elektronske gostote in posledično pozitivno delno obremenitev.
Ta obremenitev odraža stanje oksidacije ogljika v organski spojini. V katerem koli drugem je ogljik tako zarjavel kot v primeru karboksilnih kislin, ta oksidacija pa je sorazmerna s stopnjo reaktivnosti spojine.
Zaradi tega skupina -Cooh prevladuje proti drugim organskim skupinam in definira glavno gazirano naravo in glavno gazirano verigo spojine.
Zato ni kislinskih derivatov aminov (R-NH2), vendar aminos, ki izhajajo iz karboksilnih kislin (aminokisline).
Nomenklatura
Skupna imena, pridobljena iz latinščine za karboksilne kisline.
Glede na potrebo po teh pojasnilih nastane sistematična nomenklatura IUPAC za imenovanje karboksilne kisline.
Vam lahko služi: bromova: zgodovina, struktura, elektronska konfiguracija, lastnosti, uporabeTo nomenklaturo ureja več pravil, nekatera pa so:
Pravilo 1
Če omenjam karboksilno kislino, je treba ime njenega alkana spremeniti tako, da dodate pripono "ICO". Tako za etana (izberite3-Pogl3) Njegova ustrezna karboksilna kislina je etanojska kislina (CH3-COOH, ocetna kislina, enako od kisa).
Še en primer: za CHO3Pogl2Pogl2-COOH El Alcano postane butan (ch3Pogl2Pogl2Pogl3) in zato je imenovana butanojska kislina (manska kislina, enaka rantidnega masla).
Pravilo 2
Skupina -COOH definira glavno verigo, število, ki ustreza vsakemu ogljiku, pa se šteje iz karbonila.
Na primer CHO3Pogl2Pogl2Pogl2-COOH je pentanojska kislina, šteje od enega do petih ogljikov do metila (izberite3). Če je druga metilna skupina povezana s tretjim ogljikom, bi bila to Cho3Pogl2Ch (pogl3) Pogl2-COOH, ki je nastala zdaj nomenklatura: 3-metilpentanska kislina.
Pravilo 3
Pred substituentom je število ogljika, na katerega so povezani. Prav tako so lahko ti substituenti dvojne ali trojne povezave in dodajo „ICO“ pripono enako alkeni in alkini. Na primer CHO3Pogl2Pogl2Ch = chch2-COOH je omenjen kot kislina (cis ali trans) 3- heptenoic.
Pravilo 4
Ko je R veriga sestavljena iz obroča (φ). Kislina se omenja, začenši z imenom obroča in konča z "karboksilno" pripono. Na primer, φ-cooh je poimenovan kot benzecenokarboksilna kislina.
Struktura karboksilne kisline
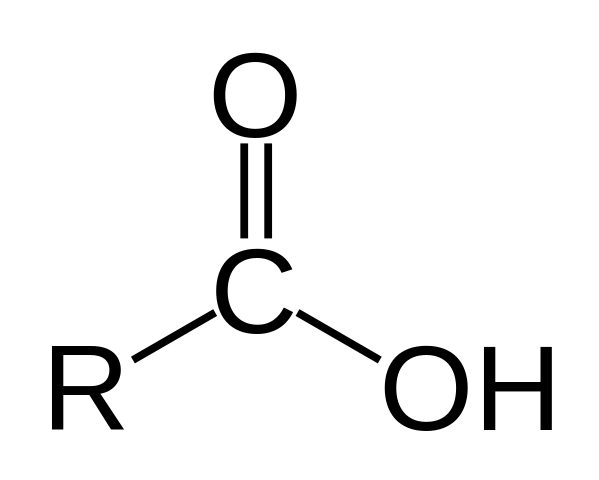 Struktura karboksilne kisline. R je vodik ali gazirana veriga.
Struktura karboksilne kisline. R je vodik ali gazirana veriga. Na zgornji sliki je predstavljena splošna struktura karboksilne kisline. Stranska veriga R je lahko poljubna ali ima vse vrste substituentov.
Atom ogljika ima hibridizacijo SP2, kar vam omogoča, da sprejmete dvojno vez in ustvarite kote povezave približno 120 °.
Zato lahko to skupino asimiliramo kot raven trikotnik. Zgornji kisik je bogat z elektroni, spodnji vodik. To je mogoče opaziti v resonančnih strukturah z dvojno vezi.
Vodik je dodeljen za bazo in zaradi tega ta struktura ustreza kislini spojini.
Vam lahko služi: amineLastnosti karboksilne kisline
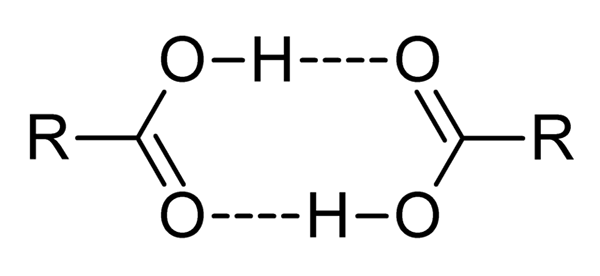
Karboksilne kisline so zelo polarne spojine, intenzivni vonji in z enostavnostjo učinkovito interakcije med seboj s vodikovimi mostovi, kot prikazuje vrhunska slika.
Ko na ta način medsebojno delujeta dve karboksilni kislini, se oblikujejo dímeros, ki je dovolj stabilen, da obstaja v plinski fazi.
Mostovi vodika in premera povzročajo karboksilne kisline, ki imajo višje vrelišča kot voda. To je zato, ker mora energija v toploti izhlapevati ne le molekulo, ampak na dimer, ki ga povezujejo tudi ti vodikovi mostovi.
Majhne karboksilne kisline čutijo veliko afiniteto za vodo in polarna topila. Ko pa je število ogljikovih atomov večje od štirih, prevladuje hidrofobni značaj R verig in postane nepomembno z vodo.
V trdni ali tekoči fazi igrajo dolžina R verige in substituentov, ki jih ima. Tako, ko so verige zelo dolge, med seboj komunicirajo prek londonskih disperzijskih sil, kot v primeru maščobnih kislin.
Kislost
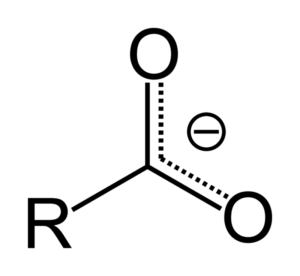
Ko karboksilna kislina podari proton, postane karboksilat anion, predstavljen na zgornji sliki. V tem anionu se negativna obremenitev premesti med dve atomi ogljika, ki jo stabilizira in zato daje prednost reakciji, da se pojavi.
Kako se spreminja to kislost od ene karboksilne kisline na drugo? Vse je odvisno od kislosti protona v skupini OH: revnejši v elektroni, več kisline.
To kislost se lahko poveča, če je ena od verižnih nadomestkov RA elektronegativna vrsta (ki privabi ali umakne elektronsko gostoto iz okolice).
Na primer, če je v CHO3-COOH nadomestimo h metilne skupine z atomom fluora (CFH2-COOH) Kislost se znatno poveča, ker F umakne elektronsko gostoto iz karbonila, kisika in nato vodika. Če so vsi h nadomeščeni s F (CF3-COOH) Kislost doseže največjo vrednost.
Vam lahko služi: vodik: zgodovina, struktura, lastnosti in uporabeKaj spremenljivka določa stopnjo kislosti? PKdo. Nižji pkdo In bližje 1, večja je sposobnost kisline, da se disociira v vodi in posledično bolj nevarna in škodljiva. Iz prejšnjega primera Cf3-COOH ima najnižjo vrednost PKdo.
Uporaba/uporaba karboksilnih kislin
Zaradi neizmerne raznolikosti karboksilnih kislin ima vsaka od njih potencialno uporabo v industriji, naj bo to polimeri, farmacevtski ali hrani.
Prehrambena industrija
- Dodatki.
- Konzervansi (sorbinska kislina in benzojska kislina).
- Regulator alkalnosti številnih izdelkov.
- Proizvodnja brezalkoholnih pijač.
- Protimikrobna sredstva pred delovanjem antioksidantov. V tem primeru je trend tekoči protimikrobni.
- Glavna sestavina skupnega kisa (ocetna kislina).
- Kislina v gaziranih pijačah in hrani (citronska kislina in mlečna kislina).
- Pomočnik pri zorenju švicarskega sira (propionska kislina).
- Sir, chucrut, fermentirani colm in brezalkoholne pijače (mlečna kislina).
Farmacevtska industrija
- Antipiretična in analgetična (acetilsalicilna kislina).
- Aktivno v procesu sinteze arome, pri nekaterih zdravilih (butirska ali butanojska kislina).
- Antimikotična (benzojska kislina v kombinaciji s salicilno kislino).
- Aktivno za proizvodnjo zdravil vitamina C (askorbinska kislina).
- Fungicid (kaprilična kislina).
- Izdelava nekaterih odvajal (hidroksibotanodijeva kislina).
Druge panoge
- Izdelava plastike in maziva (sorbinska kislina).
- Izdelava lakov, elastičnih smol in prozornih lepil (akrilna kislina).
- Izdelava slik in lakov (linolna kislina).
- Izdelava mil, detergentov, šamponov, kozmetike in čistilnih izdelkov (oleinska kislina).
- Proizvodnja zobnih testenin (salicilna kislina).
- Produkcija rajona acetata, fotografski filmi in topila za barve (ocetna kislina).
- Barvilo in porjavelo proizvodnjo (metan kislina).
- Priprava mazivnih olj, vodoodpornih materialov in sekalnih slik (palmitinska kislina).
- Proizvodnja gume (ocetna kislina).
- Gumijasta izdelava in galvanoplastika.
- Topilo.
- Proizvodnja parfumov (benzojska kislina).
- Izdelava mehčalcev in smol (fotolska kislina).
- Izdelava poliestra (tereftalna kislina).
- Priprava parafinskih sveč (stearinska kislina).
Reference
- Graham Solomons t.W., Craig b. Fryhle. Organska kemija. Karboksilne kisline in njihovi derivati (10. izdaja., stran 779-783). Wiley Plus.
- Organske kisline. Naturalwellbeing si je opomogel.com
- Frančišek a. Želva. Organska kemija. Karboksilne kisline. (Šesta izdaja., Stran 805-820). MC Graw Hill.
- William Reusch. Karboksilne kisline. Okreval od kemije.MSU.Edu

