Struktura ogljikove kisline (H2CO3), lastnosti, sinteza, uporablja

- 1174
- 21
- Roman Schamberger
On ogljikova kislina Gre2Co3. Zato je diprotična kislina, ki lahko podari dva H iona+ v vodno okolje za ustvarjanje dveh molekulskih kationov h3Tudi+. Iz njega se pojavijo dobro znani bikarbonatni ioni (HCO3-) in karbonat (co32-).
Ta posebna kislina, preprosta, vendar hkrati vključena v sisteme, kjer številne vrste sodelujejo v ravnovesju med tekočino-hlapom, tvori iz dveh temeljnih anorganskih molekul: voda in ogljikov dioksid. Prisotnost co2 Unwound je vedno opaziti, da je v vodi mehurček, ki se povzpne na površino.
 Kozarec z uplinjano vodo, ena najpogostejših pijač, ki vsebuje ogljikovo kislino. Vir: pxhere.
Kozarec z uplinjano vodo, ena najpogostejših pijač, ki vsebuje ogljikovo kislino. Vir: pxhere. Ta pojav se redno vidi v brezalkoholnih pijačah in gazirani vodi.
V primeru gazirane ali uplinjane vode (vrhunska slika) je bila takšna količina raztopljena2 da je vaš tlak s paro več kot dvojni atmosferski tlak. Z razkritjem ga razlika v tlaku znotraj steklenice in zunanjosti zmanjša topnost CO2, Tako se pojavljajo mehurčki, ki na koncu uhajajo tekočino.
V manjši meri se isto zgodi v kateri koli masi sveže ali slane vode: ko jih segrejejo, bodo sprostili raztopljeno vsebnost CO2.
Vendar pa Co2 Ni samo raztopljen, ampak trpi transformacije v svoji molekuli, zaradi česar je H2Co3; Kislina, ki ima zelo drobno življenje, vendar dovolj, da označi očarljivo spremembo pH vodnega okolja topila in ustvari tudi edinstven sistem karbonatnega pufra.
[TOC]
Struktura
Molekula
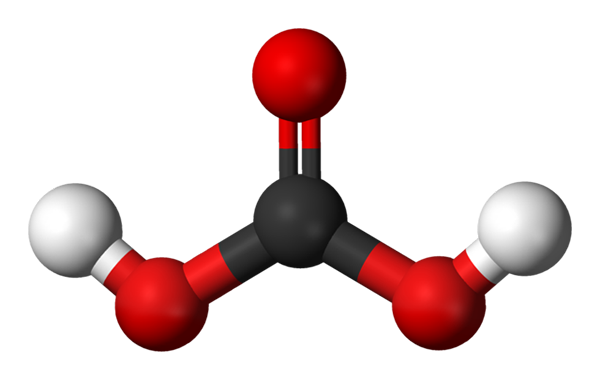 Molekula ogljikove kisline, predstavljena z modelom kroglic in palic. Vir: Jynto in Ben Mills prek Wikipedije.
Molekula ogljikove kisline, predstavljena z modelom kroglic in palic. Vir: Jynto in Ben Mills prek Wikipedije. Zgoraj imamo molekulo H2Co3, zastopano s kroglami in palicami. Rdeče kroglice ustrezajo atomom kisika, črni do ogljikov atom in beli vodikovi atomi.
Upoštevajte, da lahko iz slike napišete drugo veljavno formulo za to kislino: CO (OH)2, kjer co postane karbonilna skupina, c = o, povezana z dvema hidroksilnima skupinama, OH. Ko obstajata dve skupini OH, ki sta sposobna darovati njihove vodikove atome, je zdaj razumljivo, od kod prihajajo H ioni+ izpuščeno na sredini.
 Molekularna struktura ogljikove kisline.
Molekularna struktura ogljikove kisline. Upoštevajte, da formula Co (OH)2 Lahko ga zapišemo kot ohcooh; to je od vrste rcooh, kjer v tem primeru postane R skupina OH.
Iz tega razloga je poleg dejstva, da molekula sestavljajo kisik, vodik in ogljikove. Vendar pa bo v delu svoje sinteze razloženo, zakaj drugi menijo, da je anorganska in neekorganska narava.
Vam lahko služi: dihidroxyaceton: struktura, lastnosti, pridobivanje, uporabeMolekularne interakcije
Molekule h2Co3 Lahko komentiramo, da je njegova geometrija trigonalna ravna, z ogljikom, ki se nahaja v središču trikotnika. V dveh svojih točkah ima skupine OH, ki so darovalci vodikovih mostov; In v preostalem drugem atom kisika skupine C = O, sprejemnik vodikovega mostu.
Tako, h2Co3 Ima močno nagnjenost k interakciji s protikami ali kisikovimi topili (in tudi dušikom).
In naključno voda ustreza ta dve značilnosti, afiniteta H pa je taka2Co3 zanjo, ki ji skoraj takoj da h+ In ravnovesje hidrolize, ki vključuje vrste HCO3- in h3Tudi+.
Zato zgolj prisotnost vode razgradi ogljikovo kislino in svojo izolacijo naredi kot čista spojina preveč zapletena.
Čista ogljikova kislina
Vrnitev na molekulo H2Co3, Ne samo, da je ravno, da lahko vzpostavi vodikove mostove, ampak lahko predstavlja tudi cis-transia; To je, na sliki imamo cis izomer, z dvema h, ki kažeta v isto smer, medtem ko bi v trans izomeru pokazali v nasprotne smeri.
Izomer Cis je najbolj stabilen od obeh, zato je edini, ki je običajno predstavljen.
Čista trdna snov h2Co3 Sestavljen je iz kristalne strukture, sestavljene iz plasti ali molekul, ki delujejo v interakciji s stranskimi vodikovimi mostovi. To je pričakovano, saj je molekula h2Co3 Ravno in trikotno. Ko sublimalno, se pojavijo ciklični somraki (h2Co3)2, ki se pridružita dva vodikova mostova c = o - OH.
Simetrija HR2Co3 Ni ga bilo mogoče opredeliti s trenutki. Šteje se, da je kristaliziran kot dva polimorfa: α-H2Co3 in β- h2Co3. Vendar α-H2Co3, sintetizirano na podlagi mešanice CHO3COOH-CO2, Dokazano je bilo, da je pravzaprav CHO3Oroh: monometrija karbonska kislina.
Lastnosti
Omenjeno je bilo, da h2Co3 To je diprotična kislina, zato lahko podarite dva h iona+ do medija, ki jih sprejme. Ko je ta medij voda, so enačbe njegove disociacije ali hidrolize:
H2Co3(Ac) + h2Ali (l) HCO3-(Ac) + h3Tudi+(Ac) (ka1 = 2,5 × 10−4)
HCO3-(Ac) + h2Ali (l) co32-(Ac) + h3Tudi+(Ac) (ka2 = 4,69 × 10−11)
HCO3- Je bikarbonat ali hidrogenokarbonatni anion in CO32- Karbonatni anion. Nakazujejo tudi njihove ravnotežne konstante, KA1 in ka2. Biti ka2 pet milijonov krat manjših od ka1, Tvorba in koncentracija co32- So zaničljivi.
Torej, tudi če gre za diprotično kislino, drugi h+ Komaj ga sprostite. Vendar pa prisotnost CO2 Raztopljeno v velikih količinah, dovolj, da zakisa medij; V tem primeru voda, ki znižuje svoje pH vrednosti (pod 7).
Vam lahko služi: fuzijaPogovor o ogljikovi kislini se praktično nanaša na vodno raztopino, kjer prevladujejo vrste HCO3- in h3Tudi+; Ni ga mogoče izolirati z običajnimi metodami, saj bi najmanj poskusi izpodrinili ravnovesje topnosti CO2 na tvorbo mehurčkov, ki bi pobegnili iz vode.
Sinteza
Raztapljanje
Ogljikova kislina je ena najlažjih spojin za sintezo. Kot? Najpreprostejša metoda je, da se s pomočjo slame ali sorbeta, zraka, ki ga izdihnemo v volumnu vode. Ker izdihnemo v Essence Co2, Ta mehurček v vodi, ki raztaplja majhen delček istega.
Ko to storimo, pride do naslednje reakcije:
Co2(g) + h2Ali (l) h2Co3(AC)
Vendar je treba upoštevati topnost CO2 v vodi:
Co2(g) co2(AC)
Oba co2 kot h2Ali so anorganske molekule, torej h2Co3 To je anorgansko, odkar je videti to točko.
Ravnotežje s tekočino-hlapom
Kot rezultat imamo sistem v ravnotežju, ki je močno odvisen od delnih tlakov CO2, kot tudi temperatura tekočine.
Na primer, če je pritisk co2 Poveča se (v primeru, da z večjo silo pihamo zrak skozi sorbet), bo nastalo več h2Co3 in pH bo postal bolj kisel; Ker se prvo ravnovesje premakne v desno.
Po drugi strani pa, če segrejemo raztapljanje h2Co3, Topnost CO se bo zmanjšala2 V vodi, ker je plin, in ravnotežje se bo nato premaknilo na levo (manj bo H2Co3). Podobno bo, če poskušamo uporabiti vakuum: co2 Pobegnil bo, pa tudi molekule vode, ki bi spet premaknilo ravnotežje v levo.
Čista trdna
Zgoraj omogoča, da doseže zaključek: iz rešitve H2Co3 Ni mogoče sintetizirati te kisline kot čiste trdne snovi s konvencionalno metodo. Vendar je to storjeno od 90. let prejšnjega stoletja, ki se začne iz trdnih mešanic2 in h2Tudi.
Na to trdno mešanico co2-H2Ali pri 50% ga bombardiramo s protoni (vrsta kozmičnega sevanja), tako da nobena od obeh komponent ne bo pobegnila in nastala tvorba H2Co3. V ta namen je bila uporabljena tudi mešanica CHO3Oh-co2 (Ne pozabite α-H2Co3).
Druga metoda je isto, vendar neposredno z uporabo suhega ledu, nič več.
Od treh metod bi lahko Nasini znanstveniki dosegli zaključek: čista, trdna ali plinasta ogljikova kislina lahko obstaja v Jupitrovem sladoledu, v marsovskih ledenikih in v kometih, kjer se tako trdne mešanice nenehno obsevajo za kozmične žarke.
Vam lahko služi: volumetrična pipeta: značilnosti, uporabe, umerjanje in napakePrijave
Sama ogljikova kislina je spojina brez kakršnega koli uporabnosti. Od njegovih rešitev pa lahko pripravite rešitve za blaženje na podlagi vrstnikov HCO3-/Co32- ali h2Co3/HCO3-.
Zahvaljujoč tem rešitvam in delovanju ogljikovega encima za anhidrazo, ki je prisoten v rdečih krvnih celicah, CO2 Proizvedeno v dihanju se lahko v krvi prevaža v pljuča, kjer se končno sprosti, da se izdihne zunaj našega telesa.
Bubjueo co2 Izkoristite pitje pitja prijetnega in značilnega občutka, ki ga pustijo v grlu, ko jih pijejo.
Tudi prisotnost h2Co3 Ima geološki pomen pri nastajanju apnenčastih stalaktitov, saj jih počasi raztopi, dokler ne izvirajo iz njihovih poudarjenih zaključkov.
Po drugi strani pa lahko njihove rešitve uporabijo za pripravo nekaterih kovinskih bikarbonatov; Čeprav je bolj donosen in enostaven za uporabo bikarbonatne soli (Nahco3, Na primer).
Tveganja
Karbonska kislina ima tako zelo majhno življenje v normalnih pogojih (ocenjujejo, da je približno 300 nanosekund), kar je praktično neškodljivo za okolje in živa bitja. Vendar, kot že rečeno, to ne pomeni, da ne more ustvariti zaskrbljujoče spremembe pH oceanske vode, ki vpliva na morsko favno.
Po drugi strani je resnično "tveganje" v vnosu uplinjene vode, saj količina CO2 raztopljen v njih je veliko večji kot v normalni vodi. Vendar pa spet ni študij, ki bi pokazale, da pitje uplinjane vode predstavlja smrtonosno tveganje; Če ga sploh priporočate za hitro in boj.
Edini negativni učinek, ki ga opazimo na tisti, ki pijejo to vodo, je občutek polnosti, saj so njihovi želodci napolnjeni s plini. Iz tega (da ne omenjam brezalkoholnih pijač, saj so sestavljene iz veliko več kot le ogljikove kisline), lahko rečemo, da ta spojina sploh ni strupena.
Reference
- Dan, r., & Underwood, a. (1989). Kvantitativna analitična kemija (peti izd.). Pearson Prentice Hall.
- Shiver & Atkins. (2008). Anorganska kemija. (Četrta izdaja). MC Graw Hill.
- Wikipedija. (2019). Ogljikova kislina. Pridobljeno iz: v.Wikipedija.org
- Danielle Reid. (2019). Ogljikova kislina: Video tvorba, struktura in kemična enačba. Študij. Okrevano od: študij.com
- Götz Bucher & Wolfram Sander. (2014). Razjasnitev strukture ogljikove kisline. Vol. 346, številka 6209, str. 544-545. Doi: 10.1126/znanost.1260117
- Lynn Yarris. (22. oktober 2014). Nova vpogled v ogljikovo kislino v vodi. Berkeley Lab. Okrevano od: NewsCenter.lbl.Gov
- Claudia Hammond. (14. septembra 2015). Je peneča voda res slaba za vas? Pridobljeno iz: BBC.com
- Jürgen Bernard. (2014). Trdna in plinasta ogljikova kislina. Inštitut za fizikalno kemijo. Univerza v Innsbrucku.
- « Zakoni o prenosu toplote, oblike prenosa, primeri
- 15 Prednosti jabolk za telesno in duševno zdravje »

