Struktura cikla (C5H10), lastnosti in uporabe
- 915
- 76
- Raymond Moen
On ciklopentano To je ciklični ogljikovodik, zlasti cikloalkano. Gre za organsko spojino, katere molekularna formula je c5H10. Lahko vizualiziramo kot zaprto različico n-Pentano, odprta veriga, v kateri so se njeni konci pridružili z izgubo dveh vodikovih atomov.
Na spodnji sliki je prikazan okostje ciklopentana. Upoštevajte, kako se nosi geometrijsko okostje, ki tvori peteronalni obroč. Vendar njegova molekularna struktura ni ravna, vendar predstavlja gube, ki si prizadevajo za stabilizacijo in zmanjšanje napetosti znotraj obroča. Kolesarjenje je zelo hlapna in vnetljiva tekočina, vendar ne toliko kot n-Pentano.
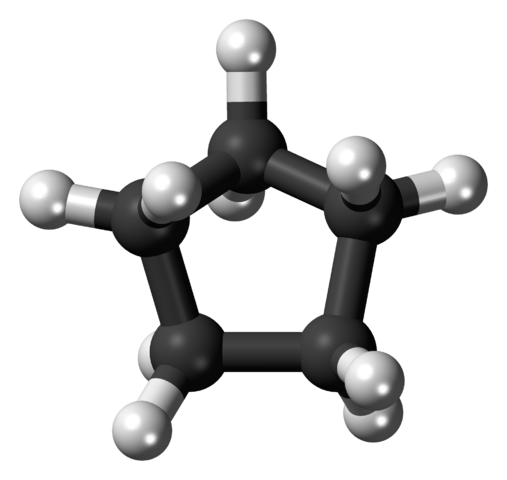
 Ogljikovo okostje ciklopentana. Vir: Ccroberts [javna domena]
Ogljikovo okostje ciklopentana. Vir: Ccroberts [javna domena] Cyclopentano je zaradi svoje zmogljivosti topila eno najbolj uporabljenih topil v kemični industriji. Ni presenetljivo, da ga med njihovo sestavo vsebujejo številni močni izdelki za vonj, zato so vnetljivi. Uporablja se tudi kot ekspanzijsko sredstvo za poliuretanske pene, ki se uporabljajo v hladilnikih.
[TOC]
Struktura Ciclipentano
Medmolekularne interakcije
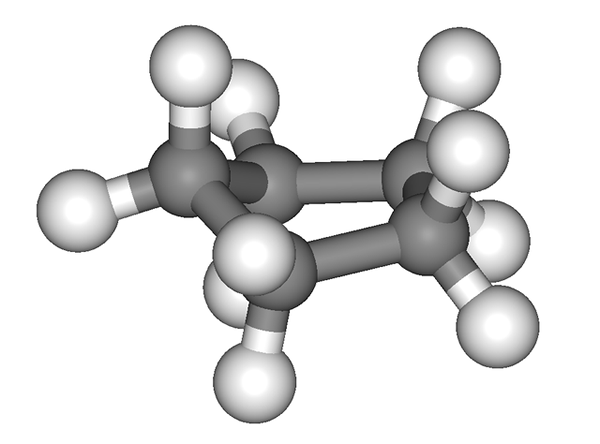
 Molekularna struktura ciklopentana, ki jo predstavlja model sfer in palic. Vir: Jynto [CC0]
Molekularna struktura ciklopentana, ki jo predstavlja model sfer in palic. Vir: Jynto [CC0] Na prvi sliki je bilo prikazano okostje ciklopentana. Zdaj vidimo, da je več kot preprost pentagon: na njegovih robovih izstopajo vodikovi atomi (bele krogle), ogljikove atomi.
Z vezmi C-C in C je njegov dipolni trenutek nepomemben, zato ciklopentano molekule ne morejo medsebojno komunicirati prek sil dipola-dipolo. Namesto tega ostajajo kohezivni zahvaljujoč londonskim razpršilnim silam, pri čemer se prstani poskušajo zložiti na drugo.
Ta sklad ponuja določeno območje stika, kot je na voljo med linearnimi molekulami n-Pentano. Kot rezultat tega ima ciklopentano večjo vrelišče kot n-Pentano, pa tudi nižji tlačni tlak.
Lahko vam služi: 7 kemijske laboratorijske prakse (preproste)Disperzivne sile so odgovorne za ciklopentano, ki tvori molekularni kristal pri zamrzovanju pri -94 ° C. Čeprav ni veliko informacij o njegovi kristalni strukturi, je to polimorfno in ima tri faze: I, II in III, ki so faza II, neurejena mešanica I in III.
Konformacija in napetost anulacije
 Obroč ciklopentano ni povsem raven. Vir: EDGAR181 [javna domena]
Obroč ciklopentano ni povsem raven. Vir: EDGAR181 [javna domena] Prejšnja slika daje lažni vtis, da je cikel ravna; Ampak ni tako. Vsi njihovi atomi ogljika imajo hibridizacijo SP3, Torej njihove orbitale niso nameščene v isti ravnini. Prav tako, kot da to ni dovolj, so vodikovi atomi zelo blizu drug drugemu, močno odbijajo, ko so zasenčeni.
Tako govori o skladnosti. S tega vidika je razvidno, da ciklopentano obroč predstavlja gube, ki pomagajo zmanjšati preklicane odpovedi zaradi svojih ogljikovih atomov, tako blizu drugega.
Ta napetost je posledica dejstva, da imajo vezi C-C kote manj kot 109'5 °, idealna vrednost za tetraedrski okoljski produkt njihovih hibridizacij SP3.
Kljub tej napetosti je cikel bolj stabilna in manj vnetljiva spojina kot Pentan. To je mogoče preveriti s primerjavo njegovih varnostnih rombusov, v katerih ima vnetljivost cikla 3, medtem ko je Pentan, 4.
Lastnosti Ciclipentano
Fizični videz
Brezbarvna tekočina z mehkim vonjem, podobnim oljem.
Vam lahko služi: faze kemijeMolarna masa
70,1 g/mol
Tališče
-93,9 ° C
Vrelišče
49,2 ° C
Plamenišče
-37,2 ° C
Temperatura samostojnosti
361 ° C
Toplota za uparjanje
28,52 kJ/mol pri 25 ° C
Goo
0,413 MPA · S
Lomni količnik
1.4065
Parni tlak
45 kPa pri 20 ° C. Ta pritisk ustreza približno približno 440 atm n-Pentano: 57,90 kPa.
Tu se kaže učinek strukture: ciklopentano obroč omogoča učinkovitejše medmolekularne interakcije, ki kohezivne in ohranjajo molekule bolj znotraj tekočine v primerjavi z linearnimi molekulami linearnih molekul n-Pentano. Zato ima slednji večji tlak na pari.
Gostota
0,751 g/cm3 pri 20 ° C. Po drugi strani so njeni hlapi 2,42 -krat gostejši od zraka.
Topnost
V litru vode pri 25 ° C se je raztopil 156 mg ciklopentana zaradi hidrofobnega značaja. Vendar pa je mešljiv v apolarnih topilih, kot so drugi parafini, eterri, benzen, ogljikov tetraklorid, aceton in etanol.
Koeficient oktanola/vode
3
Reaktivnost
Kolesarjenje je stabilno, če je pravilno shranjeno. To ni reaktivna snov, ker njegovih povezav C-H ali C-C ni enostavno razbiti, tudi kadar bi to privedlo do sproščanja energije, ki jo povzroča napetost obroča.
V prisotnosti kisika bo gorel v reakciji zgorevanja, bodisi popolnega ali nepopolnega. Ker je cikel zelo hlapna spojina, ga je treba shraniti na mestih, kjer ga ni mogoče izpostaviti nobenemu viru toplote.
Medtem bo ciklopentano v odsotnosti kisika utrpel reakcijo pirolize, ki se razgradi v manjših in nenasičenih molekulah. Eden od njih je 1-penten, ki dokazuje, da toplota zlomi ciklopentano obroč, da izvira.
Lahko vam služi: metil salicilatPo drugi strani lahko ciklopentano reagira z bromom pod ultravijoličnim sevanjem. Na ta način je ena od njegovih C-H vezi nadomeščena s C-BR, ki jo lahko nadomestijo druge skupine; In tako se pojavijo derivati ciklopentano.
Prijave
Industrijsko topilo
Hidrofobni in apolarni značaj ciklopentano je narejen z stopinjo topila, poleg drugih parafinskih topil. Zaradi tega je običajno del formulacij številnih izdelkov, kot so lepilo, sintetične smole, slike, lepila, tobak in bencin.
Vir etilena
Ko je ciklopentano podvržen pirolizi, je ena najpomembnejših snovi, ki jih ustvari, etilen, ki ima nešteto aplikacij v svetu polimerov.
Poliuretanske izolacijske pene
Ena najbolj izjemnih uporab Cycopentano je kot širitveno sredstvo za proizvodnjo poliuretanskih izolacijskih pen; To pomeni, da hlape ciklopentano po velikem pritisku razširijo polimerni material, dokler mu ne dajo pene z koristnimi lastnostmi, ki jih je treba uporabiti v okvirju hladilnikov ali zamrzovalnikov.
Nekatera podjetja so se odločila nadomestiti HFC s ciklopentano pri proizvodnji izolacijskih materialov, saj ne prispeva k poslabšanju ozonske plasti in tudi zmanjšuje sproščanje toplogrednih plinov v okolje.
Reference
- Graham Solomons t.W., Craig b. Fryhle. (2011). Organska kemija. (10th Izdaja.). Wiley Plus.
- Carey f. (2008). Organska kemija. (Šesta izdaja). MC Graw Hill.
- Wikipedija. (2020). Ciklopentan. Pridobljeno iz: v.Wikipedija.org
- Nacionalni center za informacije o biotehnologiji. (2020). Ciklopentan. Baza podatkov Pubchem, CID = 9253. Okrevano od: pubchem.NCBI.NLM.ameriški nacionalni inštitut za zdravje.Gov
- Elsevier b.V. (2020). Ciklopentan. Znanstveno. Pridobljeno iz: SCINCEDIRECT.com
- GE aparate. (11. januar 2011). Zmanjšanje emisij toplogrednih plinov v proizvodnih prostorih za hladilnik GE. Obnovi se od: tiskovna soba.GEAPPLYCACES.com
- « Emulzijski postopek emulzije, molekularni vidiki, aplikacije
- Industrial City Kako se rodi, struktura, posledice, težave »

