Kolesarske lastnosti, reakcije, uporabe, primeri
- 2382
- 582
- Lee Farrell
The Cycloalcanos So družina nasičenih ogljikovodikov s splošno formulo cnH2N ki sovpada z alkeni; Z razliko, da navidezna nenasičenost ni posledica dvojne vezi, ampak na obroču ali ciklu. Zato veljajo za alquenos izomere.
Te se tvorijo, ko linearni alkani združijo konce svojih verig, da izvirajo zaprto strukturo. Tako kot pri alkanih lahko tudi cikloalkan pokaže različne velikosti, molekulske mase, substitucije ali celo sisteme, sestavljene iz več kot enega obroča (policiklika).
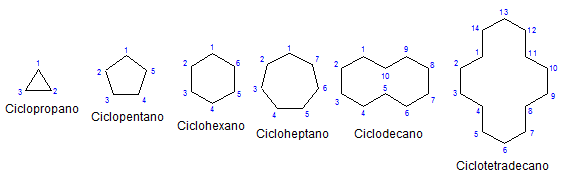
 Nekaj monocikličnih cikloalkanov. Vir: Mephisto Spa prek Wikipedije.
Nekaj monocikličnih cikloalkanov. Vir: Mephisto Spa prek Wikipedije. Preostalega, kemije in fizično so podobni alkanom. Imajo samo ogljikove in vodičeve, so nevtralne molekule in zato komunicirajo skozi sile van der Walls. Služijo tudi kot goriva in sproščajo toploto, ko gorijo v prisotnosti kisika.
Zakaj so Cycloalcanos bolj nestabilni kot njihovi odprti verižni kolegi? Razlog lahko sumimo tako.
Upoštevajte, da je manj ogljika (navedenih v modri barvi), bolj zaprta je struktura; In nasprotno se zgodi, ko se povečajo in se obračajo kot ogrlica.
Majhni cikloalci so plinasti in ker njihove velikosti povečujejo svoje medmolekularne sile. Posledično so lahko tekočina, ki lahko raztaplja maščobe in apolarne, mazive ali trdne snovi, ki izgledajo temne barve in lastnosti, kot so asfaltne barve.
[TOC]
Fizikalne in kemijske lastnosti
Polarnost
Če so sestavljeni samo iz ogljika in vodikov, atomi, ki se v elektronegativnosti ne razlikujejo preveč.
Ne morejo komunicirati s pomočjo dipol-dipolskih sil, vendar so odvisni posebej od londonskih sil, ki so šibke, vendar se to povečujejo z molekularno maso. Zato so majhni cikloalcanos (z manj kot petimi ogljikovimi) plinasti.
Medmolekularne interakcije
Po drugi strani pa imajo Cycloalcanos večjo kontaktno območje, ki daje prednost londonskim silam med njihovimi molekuli. Tako so v primerjavi z alkani združeni in bolje komunicirajo; In zato so njegove vrele in fuzijske točke višje.
Ker imata dva manj vodikova atoma (cnH2N Za cikloalcanos in cnH2N+2 Za alkane) so lažji; In k temu dodaja dejstvo njegovega največjega kontaktnega območja, zmanjšuje količino, ki jo zasedajo njegove molekule, zato so gostejše.
Nasičenost
Zakaj so cikloalkanosi kot nasičeni ogljikovodiki razvrščeni? Ker imajo način, kako vključujejo molekulo vodika; Razen če se obroč ne odpre, in v tem primeru bi postali preprosti alkani. Da se ogljikovodik šteje za nasičeno, mora imeti največje možno število povezav C-H.
Lahko vam postreže: potenciometer (fameter)Stabilnost
Kemično so zelo podobni alkani. Oba imata C-C in C-H povezave, ki jih ni tako enostavno razbiti, da bi lahko povzročili druge izdelke. Vendar se njihova relativna stabilnost razlikuje, kar je mogoče eksperimentalno preveriti z merjenjem njihovih zgorevanja ogrevanja (ΔHglavnik).
Na primer, če primerjamo ΔHglavnik Za propan in ciklopropo (ki ga predstavlja trikotnik na sliki) je 527,4 kcal/mol in 498,9 kcal/mol.
Podrobnost je, da ciklopropanglavnik manjši (471 kcal/mol), ker so tri metilenske skupine, Cho2; Toda v resnici sprošča več toplote, kar odraža nestabilnost, večjo od ocenjene. Ta odvečna energija pravi, da je posledica napetosti znotraj obroča.
In pravzaprav te napetosti urejajo in razlikujejo reaktivnost ali stabilnost cikloalkanov glede na alkane proti specifičnim reakcijam. Dokler napetosti niso zelo visoke, so cikloalcanos ponavadi stabilnejši od njihovih vrhov.
Nomenklatura
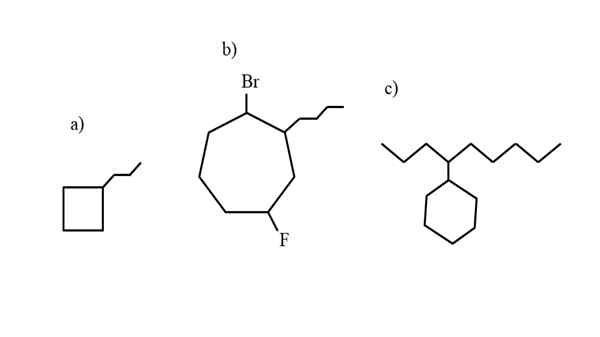 Nekaj primerov substituiranega cikloalcana za testiranje pravil nomenklature. Vir: Gabriel Bolívar.
Nekaj primerov substituiranega cikloalcana za testiranje pravil nomenklature. Vir: Gabriel Bolívar. Nomenklatura, ki jo ureja IUPAC za cikloalcanos, se ne razlikuje preveč kot pri alkanih. Najpreprostejše pravilo je, da cikla postavimo na ime alkana, ki ga tvori cikloalkano.
Tako na primer n-heksana, cho3Pogl2Pogl2Pogl2Pogl2Pogl3, Cikloheksan dobimo (na prvi sliki ga predstavlja šesterokotnik). Na enak način se zgodi s ciklopropanom, ciklobutanom itd.
Zdaj lahko te spojine trpijo nadomestke enega od njihovih vodikov. Kadar je število ogljikov obroča večje od števila najemnih nadomestkov, se obroč vzame kot glavna veriga; To je primer a) za vrhunsko sliko.
Upoštevajte, da ima v a) ciklobutane (kvadrat) več ogljikov kot skupina Propilus, povezana z njim; Potem je ta spojina poimenovana kot propilciclobutano.
Če je več kot en substituent, jih je treba poimenovati po abecednem vrstnem redu in na tak način, da imajo najmanj možno številko lokatorja. Na primer, B) se imenuje: 1-bromo-4-fluoro-2-butilcicloheptano (in ne 1-bromo-5-fluoro-7-butilcicloheptano, ki bi bil napačen).
In končno, ko ima alkični substituent več ogljikov kot obroč, potem je rečeno, da je slednja nadomestna skupina glavne verige. Tako se imenuje C): 4-cikloheksilnonano.
Vam lahko postreže: kovinski oksidiStruktura
Če pustite ob strani substituirane cikane, se je priročno osredotočiti le na njihove strukturne podlage: prstane. Ti so bili predstavljeni na prvi sliki.
Ko jih opazujemo, se lahko pojavi lažna ideja, da so takšne molekule ravne; Toda z izjemo ciklopropoma so njegove površine "cikzagenante", karboni pa se spuščajo ali nalagajo glede na isto ravnino.
To je zato, ker imajo vsi ogljikovi hibridizacijo sp3, in zato predstavljajo tetraedrske geometrije z 109,5 ° povezavami. Če pa je geometrija obročev natančno opaziti, je njihovi koti nemogoče; Na primer, koti znotraj ciklopropanskega trikotnika so 60 °.
To je tisto, kar je znano kot kotna napetost. Večji kot so obroči, kot med C-C povezavami je bližje 109,5 °, kar povzroči zmanjšanje takšne napetosti in povečanje stabilnosti za cikloalcan.
Drug primer je opažen v ciklobutanu, katerega koti povezave so 90 °. Že v ciklopentanu so njegovi koti 108 °, iz cikloheksana.
Skladnosti
Poleg kotne napetosti obstajajo tudi drugi dejavniki, ki prispevajo k napetosti, ki jih doživlja Cycloalcanos.
Povezave C-C se ne morejo vrteti brez več, saj bi to pomenilo, da se celotna struktura "trese". Tako lahko te molekule sprejmejo zelo dobro opredeljene prostorske skladbe. Namen teh gibanj je zmanjšati napetosti, ki jih povzročajo v mrku vodikovih atomov; to je, ko je eden pred drugim.
Na primer, skladnosti za ciklobutane spominjajo na metulj, ki premaga njena krila; tisti iz ciklopentana, ovojnice; Tisti iz cikloheksana, čolna ali stola in večji je prstan, večje je število in oblike, ki jih lahko sprejmejo v vesolju.
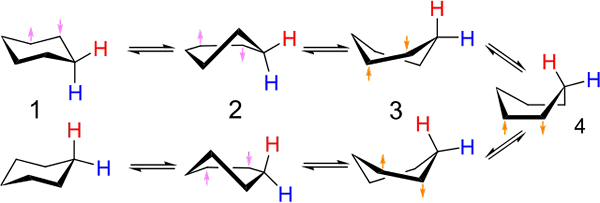 Naložbe med konformacijo tipa stola in čolna za cikloheksan. Vir: Kministi [CC0].
Naložbe med konformacijo tipa stola in čolna za cikloheksan. Vir: Kministi [CC0]. Vrhunska slika prikazuje primer takšnih skladb za cikloheksan. Upoštevajte, da se domnevni ravno šesterokotniki res zdi bolj kot stol (levo od slike) ali čoln (desno). Vodik je predstavljen z rdečimi besedili in drugim z modrimi besedili, ki kažejo, kako se njihovi relativni položaji spreminjajo po naložbah.
V (1), ko je vodik pravokoten na obročno ravnino, se reče, da je v osnem položaju; In ko je vzporedno s tem, se reče, da je v ekvatorialnem položaju.
Reakcije
Reakcije, ki jih lahko trpi Cycloalcan, so enake kot za alkane. Oba izgoreva v prisotnosti presežka kisika v značilnih reakcijah zgorevanja, da nastane ogljikov dioksid in vodo. Prav tako lahko oba utrpita halogenacije, v katerih vodik nadomesti halogenski atom (F, Cl, Br, I).
Lahko vam služi: prednosti in slabosti zdravstvene kemije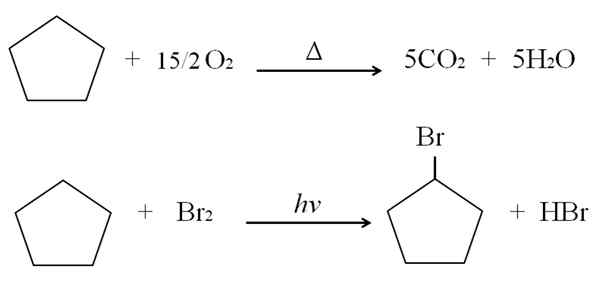 Reakcije ciklopentano. Vir: Gabriel Bolívar.
Reakcije ciklopentano. Vir: Gabriel Bolívar. Nad zgorevanje in halogenacijsko reakcijo za ciklopentano so prikazane kot primer. En mol gori v prisotnosti toplote in 7,5 molov molekularnega kisika, da se razgradi na CO2 in h2Tudi. Po drugi strani pa v prisotnosti ultravijoličnega in broma.
Prijave
Uporaba Cycloalcanos je v veliki meri odvisna od njihovega števila ogljika. Najlažji in zato plinasti, ki so bili nekoč postregli s plinskimi svetilkami javnih luči.
Tekočine imajo medtem dobiček kot topila olj, maščob ali komercialnih izdelkov apolarne narave. Med njimi lahko omenite ciklopentano, cikloheksan in cikloheptane. Prav tako se pogosto uporabljajo v rutinskih operacijah v Petróleos Laboratories ali v formulaciji goriva.
Če so težji, jih lahko uporabimo kot maziva. Po drugi strani pa lahko predstavljajo tudi začetni material za sintezo zdravil; Kot karboplatin, ki v svojo strukturo vključuje obroč ciklobutana.
Primeri cikanala
Končno se vrne na začetek članka: Slika z več ne -omejenimi cikloalkanosi.
Če si zapomnimo cikloalkanos, je dovolj za razmislek o geometrijskih figurah: trikotniku (ciklopropanu), kvadratu (ciklobutanu), Pentagonu (Cyclopentano), šesterokotniku.
Večji kot je prstan, manj spominja na svojo geometrijsko figuro. Že je bilo videti, da je cikloheksan vse razen šesterokotnika; Enako se zgodi bolj očitno s ciklootRadecano (štirinajst ogljikov).
Prihaja točka, kjer se bodo obnašali kot ogrlice, ki jih je mogoče zložiti, da zmanjšajo napetosti njihovih povezav in mrk v največji meri.
Reference
- Morrison, r. T. in Boyd, r, n. (1987). Organska kemija. 5. izdaja. Uredništvo Addison-Wesley Interamerican.
- Carey f. (2008). Organska kemija. (Šesta izdaja). MC Graw Hill.
- Graham Solomons t.W., Craig b. Fryhle. (2011). Organska kemija. Amine. (10. izdaja.). Wiley Plus.
- Kemija librettexts. (2. junij 2019). Poimenovanje cikloalkanov. Okrevano od: kem.Librettexts.org
- Wikipedija. (2019). Cikloalkane. Pridobljeno iz: v.Wikipedija.org
- Clark Jim. (2015). Predstavitev alkav in cikloalkanov. Okrevano od: Chemguide.co.Združeno kraljestvo
- James Ashenhurst. (2019). Skladi in cikloalkani. Glavna organska kemija. Okrevano od: mastersorganicChemistry.com
- Fernández Germán. (s.F.). Cycloalcanos-Toria. Organska kemija. Okrevano od: Chemicicaorganica.org

