Lastnosti kalijevega cianida (KCN), uporabe, strukture, tveganja,

- 813
- 98
- Roman Schamberger
On Kalijev cianid Gre za anorgansko spojino, ki jo tvori ionski kalij k+ in cn cianidni ion-. Njegova kemična formula je kcn. Je kristalno bela trdna, izjemno strupena.
KCN je zelo topen v vodi in pri raztapljanju je hidrolizirana, ki tvori cianhidrično kislino ali HCN vodikov cianid, ki je tudi zelo strupen. Kalijev cianid lahko tvori sestavljene soli z zlatom in srebrom, tako da so ga uporabili za pridobivanje teh dragocenih kovin iz nekaterih mineralov.
 Trden KCN kalijev cianid. Morienus (Naložil DE: Benutzer: BXXXD iz: Wiki) [CC BY-SA 3.0 (http: // creativeCommons.Org/licence/by-sa/3.0/]]. Vir: Wikimedia Commons.
Trden KCN kalijev cianid. Morienus (Naložil DE: Benutzer: BXXXD iz: Wiki) [CC BY-SA 3.0 (http: // creativeCommons.Org/licence/by-sa/3.0/]]. Vir: Wikimedia Commons. KCN se uporablja za prekrivanje poceni kovin z zlatom in srebrom skozi elektrokemijski postopek, to je metoda, v kateri se skozi raztopino prenaša električni tok, ki vsebuje sol, sestavljeno iz plemenite kovine, cianida in kalija.
Kalijev cianid, ker vsebuje cianid, je treba manipulirati z veliko previdno, z ustreznimi pripomočki. Nikoli ga ne smemo zavreči v okolje, saj je tudi zelo strupen za večino živali in rastlin.
Vendar se preučujejo metode, ki uporabljajo skupne alge za odstranjevanje onesnaženega kalijevega cianida z nizkimi koncentracijami tega.
[TOC]
Struktura
KCN je ionska spojina, ki jo tvori kalijev kation k+ in cianid anion cn-. V tem je atom ogljika povezan z dušikovim atomom s trojno kovalentno vezjo.
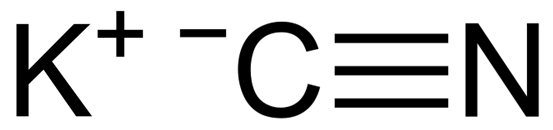 KCN Kemična struktura kalijevega cianida. Kapacit [cc by-sa 3.0 (https: // creativeCommons.Org/licence/by-sa/3.0)]. Vir: Wikimedia Commons.
KCN Kemična struktura kalijevega cianida. Kapacit [cc by-sa 3.0 (https: // creativeCommons.Org/licence/by-sa/3.0)]. Vir: Wikimedia Commons. V trdnem kalijevem cianidu CN anion- Prosto se lahko vrti s tem, kar se obnaša kot sferični anion, zato ima kristal KCN kubično strukturo, podobno strukturi kalijevega klorida KCl.
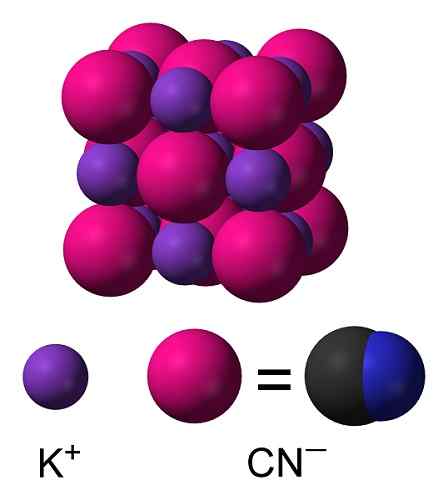 KCN kristalna struktura. Benjah-BMM27 [javna domena]. Vir: Wikimedia Commons.
KCN kristalna struktura. Benjah-BMM27 [javna domena]. Vir: Wikimedia Commons. Nomenklatura
- Kalijev cianid
- Kalijev cianid
- Cianopotasio
Lastnosti
Fizično stanje
Bela kristalna trdna. Kubični kristali.
Molekularna teža
65,116 g/mol.
Tališče
634,5 ° C
Lahko vam služi: aluminijev sulfat (AL2 (SO4) 3)Vrelišče
1625 ° C.
Gostota
1,55 g/cm3 pri 20 ° C.
Topnost
Zelo topno v vodi: 716 g/L pri 25 ° C in 100 g/100 ml vode pri 80 ° C. Malo topnega v metanolu: 4,91 g/100 g metanola pri 19,5 ° C. Zelo malo topno v etanolu: 0,57 g/100 g etanola pri 19,5 ° C.
ph
Vodna raztopina 6,5 g KCN v 1 L vode ima pH 11,0.
Konstantna hidroliza
Kcn je zelo topen v vodi. Ko je cianidni ion CN brezplačen- ki vzame proton h+ vode, da tvori hcn cianhidrično kislino in sprošča OH ion-:
Cn- + H2O → hcn + oh-
Konstanta hidrolize kaže na trend, s katerim se izvaja omenjena reakcija.
Kh = 2,54 x 10-5
Vodne raztopine KCN sproščajo HCN vodikovo cianidno okolje, ko segrejejo 80 ° C.
Kemične lastnosti
Ni vnetljivo, toda ko se trden KCN segreje, dokler njegova razgradnja ne oddaja zelo strupenega HCN vodikovega cianida, dušikovi oksidi nex, K -Potassium oksid2O in ogljikov monoksid.
KCN reagira z zlatimi soli, ki tvorijo kalijev aurocianuro kau (CN)2 in kalijev auricianuro kau (CN)4. To so kompleksi brezbarvne soli. S srebrnim kovinskim Ag KCN tvori kalijev argentocianid KAG (CN)2.
Cianidni ion KCN reagira z določenimi organskimi spojinami, ki imajo halogene (na primer klor ali bromin) in zavzema mesto teh. Na primer, reagira z bromoocetno kislino, da da cianoocetno kislino.
Druge lastnosti
Je higroskopska, absorbira vlaga okolja.
Ima mehak vonj po grenkih mandljih, vendar tega ne zaznajo vsi ljudje.
Pridobivanje
KCN pripravimo z reakcijo kalijevega hidroksida Koh v vodni raztopini s HCN hidrogenim cianidom. Kalijev ferocianid K dobimo tudi s segrevanjem4Vera (CN)6:
K4Vera (CN)6 → 4 kcn + 2 c + n2↑ + vera
Uporaba v kovinski elektrodi
Uporablja se v postopku pokrivanja malo dragocenih kovin z zlatom in srebrom. Gre za elektrolitski postopek, to je, da elektrika prenese skozi vodno raztopino z ustreznimi soli.
Lahko vam služi: žveplov trioksid (SO3): struktura, lastnosti, tveganja, uporabeSrebro
Uporablja se kalijev argentocianid Kag (CN)2 Do premaza s cenejšimi kovinami (AG).
Ti so nameščeni v vodno raztopino kalijevega kaga (CN)2, Kjer je pozitivna anoda ali drog čista srebrna palica (AG), katoda ali negativna drog.
Ko električni tok prehaja skozi raztopino, se srebro odloži na drugo kovino. Ko se uporabljajo cianidne soli, se srebrna plast odlaga na lepši, bolj kompakten in adherent kot v raztopine drugih spojin.
 Nekateri nakitni predmeti so pokriti s srebrom s pomočjo soli KCN. Avtor: StockSnap. Vir: Pixabay.
Nekateri nakitni predmeti so pokriti s srebrom s pomočjo soli KCN. Avtor: StockSnap. Vir: Pixabay. Zlato
Podobno v primeru zlata (AU) tudi kalijev aurocianid Kau (CN)2 in kalijev auricianuro kau (CN)4 Druge kovine se uporabljajo za elektrolitično rjave.
 Električni konektorji, prevlečeni z zlatom. CJP24 [CC BY-SA 3.0 (https: // creativeCommons.Org/licence/by-sa/3.0)]. Vir: Wikimedia Commons.
Električni konektorji, prevlečeni z zlatom. CJP24 [CC BY-SA 3.0 (https: // creativeCommons.Org/licence/by-sa/3.0)]. Vir: Wikimedia Commons. Druge uporabe
Spodaj so omenjene nekatere druge uporabe kalijevega cianida.
- Za industrijski postopek utrjevanja nitroracijskega jekla (dodatek dušika).
- Za čiščenje kovin.
- V procesih tiskanja in fotografij.
- Prej so ga uporabili za ekstrakcijo zlata in srebra iz mineralov, ki jih vsebujejo, nato pa ga je nadomestil natrijev cianid, ki je cenejši, čeprav enako strupen, čeprav enako strupen.
- Kot insekticid za zapiranje dreves, ladij, železniških avtomobilov in skladišč.
- Kot reagent v analitični kemiji, to je kemično analizo.
- Za pripravo drugih kemičnih spojin, kot so barvila in barvila.
 Izvlečenje zlata v Južni Afriki leta 1903 z uporabo KCN, kar je bilo v smrtnem onesnaževanju okoliškega okolja. Argyll, John Douglas Sutherland Campbell, vojvoda, 1845-1914; Creswicke, Louis [brez omejitev]. Vir: Wikimedia Commons.
Izvlečenje zlata v Južni Afriki leta 1903 z uporabo KCN, kar je bilo v smrtnem onesnaževanju okoliškega okolja. Argyll, John Douglas Sutherland Campbell, vojvoda, 1845-1914; Creswicke, Louis [brez omejitev]. Vir: Wikimedia Commons. Tveganja
KCN je zelo strupena spojina za živali in večino rastlin in mikroorganizmov. Je razvrščen kot super strupen. Še vedno je smrtonosno v zelo majhnih količinah.
Lahko vam služi: nikelj klorid (NICL2): struktura, lastnosti, pridobivanje, uporabeNjegov škodljiv učinek se lahko pojavi z vdihavanjem, stikom s kožo ali očmi ali zaužitjem. Zavira številne presnovne procese, zlasti krvne beljakovine, ki sodelujejo pri transportu kisika, kot je hemoglobin.
Vpliva na organe ali sisteme, bolj občutljive na pomanjkanje kisika, kot so centralni živčni sistem (možgani), kardiovaskularni sistem (srce in krvne žile) in pljuča.
 Kalijev cianid je strup. Avtor: Clker-brez vektorjev. Vir: Pixabay.
Kalijev cianid je strup. Avtor: Clker-brez vektorjev. Vir: Pixabay. Mehanizem delovanja
KCN posega v sposobnost telesa za uporabo kisika.
Cianidni ion cn- KCN ima veliko afiniteto do vere železne vere3+, Kar pomeni, da ko cianid absorbira, hitro reagira z vero3+ Kri in tkiva.
Na ta način preprečuje dihanje celic, ki vstopajo v stanje pomanjkanja kisika, ker čeprav poskušajo dihati.
Pojavi se nato prehodno stanje HippeaPnea (suspenzija dihanja) in glavobol ter končno smrt z dihalnim priporom.
Dodatna tveganja
Pri segrevanju proizvaja zelo strupene pline, kot je HCN, dušikovi oksidix, K -Potassium oksid2O in ogljikov monoksid.
Po stiku s HCN vlago, ki je zelo vnetljiva in zelo strupena.
KCN je zelo strupen tudi za vodne organizme. Nikoli ga ne smemo zavreči v okolje, saj se lahko pojavi onesnaževanje z vodo tam, kjer pijejo živali in naseljujejo ribe.
Vendar obstajajo bakterije, ki proizvajajo cianid, kot je Chromobacterium violaceum in nekatere vrste Pseudomonas.
Nedavne študije
Nekateri raziskovalci so ugotovili, da zelene alge Chlorella vulgaris Uporablja se lahko za zdravljenje onesnaženih voda s KCN kalijevim cianidom v nizkih koncentracijah.
Alge so lahko učinkovito odstranili KCN, ker je to v nizkih količinah spodbudilo rast alg, saj je aktiviralo notranji mehanizem, da bi se uprli strupenosti KCN.
To pomeni, da alge Chlorella vulgaris Lahko s tem odstrani cianid in da bi lahko s tem zasnovali učinkovito metodo za biološko zdravljenje kontaminacije cianida.
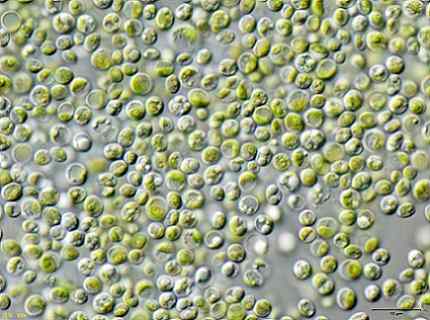 Slika alg Chlorella vulgaris opazili v mikroskopu. JA: Uporabnik: Neon / Uporabnik: Neon_JA [CC BY-SA 3.0 (https: // creativeCommons.Org/licence/by-sa/3.0)]. Vir: Wikimedia Commons.
Slika alg Chlorella vulgaris opazili v mikroskopu. JA: Uporabnik: Neon / Uporabnik: Neon_JA [CC BY-SA 3.0 (https: // creativeCommons.Org/licence/by-sa/3.0)]. Vir: Wikimedia Commons. Reference
- Ali.S. Nacionalna knjižnica medicine. (2019). Kalijev cianid. Nacionalni center za informacije o biotehnologiji. Okrevano od PubChema.NCBI.NLM.ameriški nacionalni inštitut za zdravje.Gov.
- Coppock, r.W. (2009). Grožnje za prostoživeče živali s pomočjo kemičnih vojn. V priročniku za toksikologijo kemijskih vojskovanja. Okrevano od Scientirect.com.
- Liu, q. (2017). Ocena odstranitve iz kalijevega cianida in njene strupenosti v zelenih algah (Chlorella vulgaris). Bikov okolje Contal Toxicol. 2018; 100 (2): 228-233. NCBI si je opomogel.NLM.ameriški nacionalni inštitut za zdravje.Gov.
- Nacionalni inštitut za varstvo in zdravje pri delu (NIOSH). (2011). Kalijev cianid: sistemski sredstvo. CDC je bil obnovljen.Gov.
- Alvarado, l.J. et al. (2014). Riboswitch odkritje, struktura in funkcija. Sinteza uracila. V metodah v encimologiji. Okrevano od Scientirect.com.
- « Natrijev tripolifosfat (NA5P3O10) struktura, lastnosti, uporabe, vpliv
- Ker sem zelo zaspan? 9 vzrokov in rešitev »

